题目内容
【题目】(1)某小苏打溶液中含16.8gNaHCO3,加入一定量的单质或化合物X,恰好使溶液中溶质只有Na2CO3,请你填写出X的化学式和质量.
例如:X为_____时,质量为_____;
①X为_____时,质量为_____;
②X为_____时,质量为_____;
③X为_____时,质量为_____.
(2)现有质量为18.4g的NaOH和NaHCO3的混合物.装入一密闭容器中,在120℃的温度下进行加热,经充分反应后,排出剩余气体,此时容器内固体物质的质量为16.6g.试计算原混合物中NaOH和NaHCO3的质量各为多少?_____________________、________________
(提示:![]() )
)
【答案】NaOH 8g Na 4.6g Na2O 6.2g Na2O2 7.8g NaHCO3 8.4g NaOH 10g
【解析】
(1)碳酸氢钠与氢氧化钠反应生成碳酸钠和水,加入的物质与水反应生成氢氧化钠即符合题意,所以加入的物质可以是NaOH、Na、Na2O以及Na2O2;
当X为 NaOH时,设:加入的氢氧化钠质量为 x。
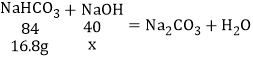
![]() x=8g;
x=8g;
①X为钠时,加入的钠与水反应生成8g氢氧化钠,即可符合题意。
设:加入钠的质量为y;
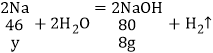
![]() y=4.6g;
y=4.6g;
②X为Na2O时,加入的Na2O与水反应生成8g氢氧化钠,即可符合题意;
设:加入Na2O的质量为z;
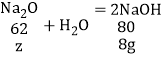
![]() z=6.2g;
z=6.2g;
③X为 Na2O2时,加入的Na2O2与水反应生成8g氢氧化钠,即可符合题意;
设:加入Na2O2的质量为a;
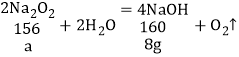
![]() z=7.8g;
z=7.8g;
因此:
X为NaOH时,质量为8g;
①X为Na时,质量为4.6g;
②X为Na2O时,质量为6.2g;
③X为Na2O2时,质量为7.8g。
(2)由于已知反应前混合物的质量和反应后固体的质量,所以有可能存在过量问题.
设:18.4g混合物正好完全反应,减少的质量为x。
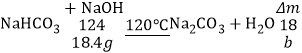
x=![]() =2.7g;因2.7g>(18.4﹣16.6)g,若是碳酸氢钠过量,碳酸氢钠会继续分解,固体质量继续减少,与题意不符,所以NaOH过量,NaHCO3完全反应;
=2.7g;因2.7g>(18.4﹣16.6)g,若是碳酸氢钠过量,碳酸氢钠会继续分解,固体质量继续减少,与题意不符,所以NaOH过量,NaHCO3完全反应;
设:参加反应的碳酸氢钠的质量为c。
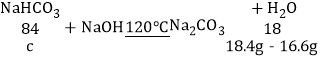
c=![]() =8.4g
=8.4g
NaOH的质量=18.4g﹣8.4g=10g;
(2)原混合物中NaOH和NaHCO3的质量各为10克和8.4克。

 每日10分钟口算心算速算天天练系列答案
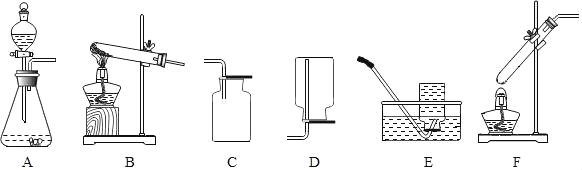
每日10分钟口算心算速算天天练系列答案【题目】某化学实验小组在进行有关CO2的实验时用到了如图所示的装置。
(1)用A装置检验CO2,试剂X为___;可观察到的现象是___;反应的化学方程式是___。若用该装置吸收CO2时,试剂X最好选用___。
(2)如图B所示,挤压胶头滴管,将NaOH溶液挤入瓶中振荡,可看到气球逐渐鼓起,其原因是_。
(3)某同学认为上述实验还不能证明CO2和NaOH发生了化学反应,请你设计补充实验,证明CO2和NaOH确实发生了化学反应。
实验步骤 | 实验现象 | 实验结论 |
____ | _____ | _____ |
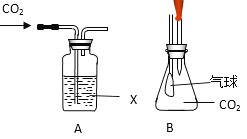
【题目】某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,得到的另一种产品NH4Cl,然后再将NaHCO3制成Na2CO3。
(1)写出仪器a的名称_____,装置丙中反应的化学方程式为_____。
(2)装置乙的作用是___________。为防止污染空气,尾气中的__________需要进行吸收处理。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有___________、___________、___________。
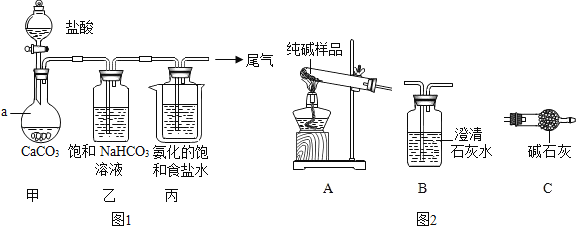
Ⅱ.测定所得产品的组成
(4)检验纯碱样品中是否混有NaHCO3,请选择如图装置设计实验,并完成下表:
选择的装置(填编号) | 实验现象 | 实验结论 |
_____ | _____ | 样品中含NaHCO3 |