题目内容
以黄铁矿为原料(主要成分是FeS2)为原料,生产硫酸的简要流程图如下: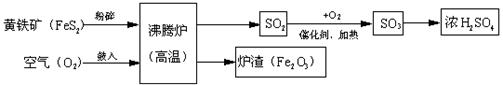
(1)写出流程图中一种氧化物的名称___________。
(2)将黄铁矿粉碎,目的是_______________________________________________。
(3)流程中SO2转化为SO3的化学方程式为_________________________________。
(4)实验室稀释浓硫酸应注意将__ ___(填“水”或“浓硫酸”)倒入 中。
(5)炉渣(Fe2O3)在工业上可用来_________,请写出反应方程式 。
(1)二氧化硫或三氧化硫或三氧化二铁
(2)增大反应物的接触面积
(3)2SO2+O2 2 SO3
2 SO3
(4)浓硫酸、水
(5)炼铁、3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
解析试题分析:(1)氧化物是指由两种元素组成的物质,别且含有氧元素的物质,所以流程图中氧化物的名称为二氧化硫或三氧化硫或三氧化二铁(2)增加反应物的接触面积,便于充分反应。(3)方程式的书写原则:以客观事实为基础、遵守质量守恒定律。反应物为SO2和O2,生成物为SO3。(4)稀释浓硫酸时应将浓硫酸沿容器壁缓慢注入水中,并用玻璃棒不断搅拌。因为浓硫酸的密度比水大,且浓硫酸溶解过程中会放出大量的热。(5)Fe2O3是是赤铁矿的主要成分,工业上可用于炼铁。
考点:物质的类别、质量守恒定律、化学方程式的书写、浓硫酸的稀释

(5分)人类的生活和生产都离不开金属材料。
(1)下列物质不属于合金的是 。
| A.青铜 | B.铝 | C.钢 | D.生铁 |
(3)焦炭可把铁从赤铁矿石里还原出来,该反应的化学方程式为 。
(4)工业上冶炼金属钛时,其中一步反应的化学方程式为:
TiO2 + 2C + 2Cl2
 TiCl4 + 2X,则X的化学式为 。
TiCl4 + 2X,则X的化学式为 。(5)在ZnCl2和CuCl2的混合溶液中,加入过量的铁粉,充分反应后过滤,所得滤液中含有的溶质是 。
我们看到过高大的铁架支撑着一根根高压电缆,这些电缆主要由铝制成.
(1)阅读“资料一”和“资料二”,回答问题.
资料一: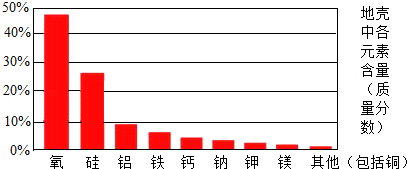
资料二:
| | 导电性(以银的导电性为100作为标准) | 密度(g/cm3) |
| 铜 | 99 | 8.92 |
| 铝 | 61 | 2.70 |
通过对上资料的分析,说明高压电缆用铝制而不用铜制的原因.
(2)铝在常温下能与氧气反应,但铝制的高压电缆却很耐腐蚀.说明其原因.
现有下列试剂:硫酸铜溶液、硝酸银溶液、硫酸铝溶液、铜片、铝片。某校九年级1班化学兴趣小组设计了下列实验方案,请你和他们一起探究银、铝、铜三种金属的活动性强弱。
| 实验步骤 | 实验现象 | 实验结论 |
| 把铝片打磨后,放入装有a:___ ________烧杯中,观察 | 铝片表面覆盖一层b: | 三种金属的活动性由强到弱的顺序为: e: |
| 把铜片打磨后,放入装有c:___________烧杯中,观察 | 铜片表面覆盖一层d: |
 Ti+2MgCl2.反应说明金属钛的活动性比镁 (填强或弱).
Ti+2MgCl2.反应说明金属钛的活动性比镁 (填强或弱).
