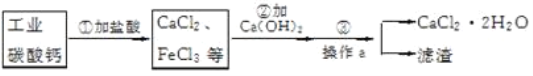
题目内容
【题目】为提高实验探究能力,某化学兴趣小组的同学在老师的指导下,对一瓶久置出现变质硬化的氢氧化钙固体进行如下探究活动。
(探究活动一)试验硬化的氢氧化钙样品是否完全变质
(1)用化学方程式表示氢氧化钙变质的原因:_____。
(2)检验氢氧化钙样品是否完全变质,进行如下实验:
实验步骤 | 实验现象 | 实验结论 |
取氢氧化钙样品少量,研细后加适量蒸馏水充分混合后静置,_____ | _____ | 该样品还含有氢氧化钙 |
(探究活动二)测定样品中含有的变质固体(以下用 R 表示)的质量分数取3克部分变质的氢氧化钙样品与足量的稀盐酸反应,测量生成气体的体积(气体不溶于植物油),从而计算出样品中R的质量,便可求出样品中R的质量分数。实验装置(气密性良好)如图 1 所示。
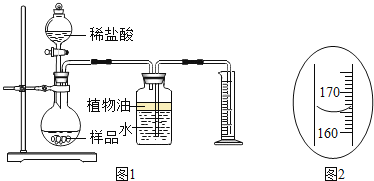
(3)将稀盐酸滴入样品中,产生气体的化学方程式为_____,反应一段后, 当观察到_____(填实验现象),才停止滴加稀盐酸。
(4)实验中量筒的作用是_____。
(5)实验结束后,量筒内进入水的体积如图 2 所示,其读数为_____mL。已知在该实验条件下,生成气体的密度为 2 g·![]() ,通过计算,样品中R的质量分数为_____。
,通过计算,样品中R的质量分数为_____。
【答案】![]() 取上层清液滴入无色酚酞试液 试液变红 2HCl+CaCO3=CaCl2+H2O+CO2↑ 不再产生气泡 根据进入量筒的水的体积,测出生成二氧化碳的体积 165 25%
取上层清液滴入无色酚酞试液 试液变红 2HCl+CaCO3=CaCl2+H2O+CO2↑ 不再产生气泡 根据进入量筒的水的体积,测出生成二氧化碳的体积 165 25%
【解析】
[探究活动一]
(1)氢氧化钙变质是因为吸收空气中的二氧化碳,二氧化碳与氢氧化钙反应生成碳酸钙和水,化学方程式为![]() 。
。
(2)检验氢氧化钙样品是否完全变质,取氢氧化钙样品少量,研细后加适量蒸馏水充分混合后静置,取上层清液滴入无色酚酞试液,观察到试液变红,溶液呈碱性,说明该样品还含有氢氧化钙。
[探究活动二]
(3)将稀盐酸滴入部分变质的样品中,样品中的碳酸钙与盐酸反应产生二氧化碳气体,化学方程式为2HCl+CaCO3=CaCl2+H2O+CO2↑。反应一段后,当观察到不再产生气泡,碳酸钙已完全反应,才停止滴加稀盐酸。
(4)实验中的量筒作用是根据进入量筒的水的体积,测出生成二氧化碳的体积。
(5)实验结束后,观察量筒内进入水的体积,其读数为165mL。
解:设样品中碳酸钙的的质量为X。
生成二氧化碳气体的质量为![]()
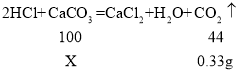
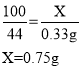
样品中碳酸钙的的质量分数为![]() 。
。
答:样品中碳酸钙的的质量分数为25%。

【题目】如表为氯化钠和硝酸钾的溶解度:
10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 70℃ | 80℃ | |
NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |
(1)60℃时,KNO3的溶解度为_____;表中“37.8”的意义是 _____。
(2)20℃时KNO3 的溶解度_____(选填“大于”“小 于”)NaCl的溶解度。随着温度升高,NaCl的溶解度 _____(选填“变大”“变小”或“不变”)。
(3)20℃时,完全溶解18 g NaCl 恰好得到饱和溶液,所需水的质量是 _____g,该溶液质量分数为 _____。
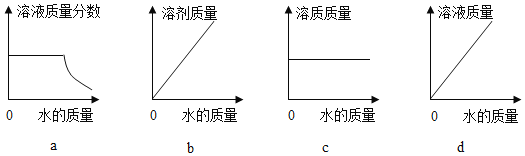
(4)20℃时,向 10 g KNO3 固体不断加水,有关图像正确的是_____(选填编号)。