题目内容
【题目】如表为氯化钠和硝酸钾的溶解度:
10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 70℃ | 80℃ | |
NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |
(1)60℃时,KNO3的溶解度为_____;表中“37.8”的意义是 _____。
(2)20℃时KNO3 的溶解度_____(选填“大于”“小 于”)NaCl的溶解度。随着温度升高,NaCl的溶解度 _____(选填“变大”“变小”或“不变”)。
(3)20℃时,完全溶解18 g NaCl 恰好得到饱和溶液,所需水的质量是 _____g,该溶液质量分数为 _____。
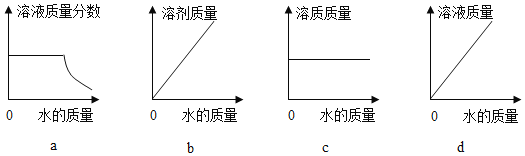
(4)20℃时,向 10 g KNO3 固体不断加水,有关图像正确的是_____(选填编号)。
【答案】110g 70℃时,在100g水中达到饱和时,可溶解37.8g氯化钠 小于 变大 50 26.5% ab
【解析】
(1)60℃时,KNO3 的溶解度为110g;表中“37.8”的意义是:在70℃时,氯化钠的溶解度为37.8g,即70℃时,在100g水中达到饱和时,可溶解37.8g氯化钠;
(2)由表格中数据可知,20℃时 KNO3 的溶解度为31.6g,小于NaCl 的溶解度36.0g。随着温度升高,NaCl 的溶解度变大;
(3)20℃时,NaCl 的溶解度为36.0g,完全溶解 18g NaCl 恰好得到饱和溶液,所需水的质量是 50 g,该溶液质量分数为 ![]() ;
;
(4)20℃时,向10g KNO3固体不断加水,开始加水时,硝酸钾未完全溶解,所以开始溶液是饱和的,硝酸钾完全溶解后,随着水的加入,溶液的溶质质量分数不断减小;而溶液中溶剂的质量随着水的增大而不断增大;溶液中溶质的质量随着硝酸钾的溶解由小到大,完全溶解后溶质的质量不再改变;当硝酸钾未完全溶解时,随着水的加入溶液的质量增大,当硝酸钾完全溶解后,溶液的质量还是随着水的加入而增大,但是增大的幅度变小;故选ab。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案【题目】在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下充分反应后,测得有关数据如下表所示:
物质 | M | N | Q | P |
反应前质量/g | 4 | 10 | 1 | 21 |
反应后质量 /g | 0 | 12 | 15 | 待测 |
已知M的相对分子质量为n,P的相对分子质量为2n,下列推理正确的是 。
A.反应后生成Q的质量为15g
B.反应中N与P发生改变的质量之比为1∶1
C.反应后P的质量为12g
D.该反应化学方程式中M与P的化学计量数之比为2∶3
【题目】为提高实验探究能力,某化学兴趣小组的同学在老师的指导下,对一瓶久置出现变质硬化的氢氧化钙固体进行如下探究活动。
(探究活动一)试验硬化的氢氧化钙样品是否完全变质
(1)用化学方程式表示氢氧化钙变质的原因:_____。
(2)检验氢氧化钙样品是否完全变质,进行如下实验:
实验步骤 | 实验现象 | 实验结论 |
取氢氧化钙样品少量,研细后加适量蒸馏水充分混合后静置,_____ | _____ | 该样品还含有氢氧化钙 |
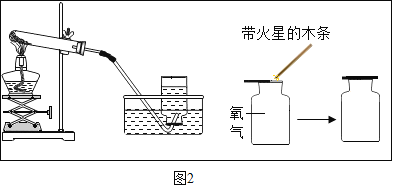
(探究活动二)测定样品中含有的变质固体(以下用 R 表示)的质量分数取3克部分变质的氢氧化钙样品与足量的稀盐酸反应,测量生成气体的体积(气体不溶于植物油),从而计算出样品中R的质量,便可求出样品中R的质量分数。实验装置(气密性良好)如图 1 所示。
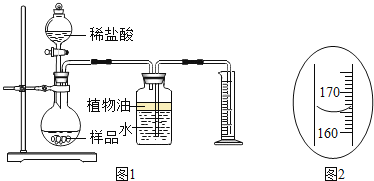
(3)将稀盐酸滴入样品中,产生气体的化学方程式为_____,反应一段后, 当观察到_____(填实验现象),才停止滴加稀盐酸。
(4)实验中量筒的作用是_____。
(5)实验结束后,量筒内进入水的体积如图 2 所示,其读数为_____mL。已知在该实验条件下,生成气体的密度为 2 g·![]() ,通过计算,样品中R的质量分数为_____。
,通过计算,样品中R的质量分数为_____。