题目内容
【题目】实验与探究是化学学习的重要方法与内容。
【探究一】中和反应的探究
①将稀盐酸逐滴加入一定量稀氢氧化钠溶液中,利用数字化传感器测得烧杯中溶液pH的变化如图所示。
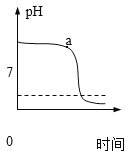
I.a点所示溶液的pH_____7(选填“>”、“<”或“=”)。
II.证明已发生中和反应的判断依据是______。
【探究二】烧碱成分的探究
②工业上常用电解饱和食盐水的方法制取烧碱,某兴趣小组为了探究久置的工业烧碱的成分,进行了如下实验:
I.取少量样品于烧杯中,加入过量稀盐酸,有气泡产生,说明样品中含有_______。
II.向上述烧杯中继续加入硝酸银溶液,出现了白色沉淀,甲同学得出结论:样品中还含有氯化钠;乙同学对该结论提出了质疑,认为不一定含有氯化钠。
乙同学质疑的理由是_________________。
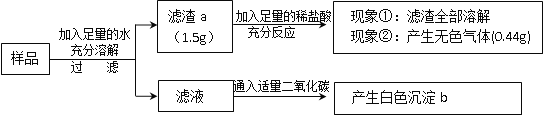
III.丙同学认为除了需要确认是否含有氯化钠外,还需要确认样品中是否含有氢氧化钠,于是,又进行了以下实验:
实 验 步 骤 | 实验现象 |
a.另取少量样品溶解于水,加入过量硝酸钙溶液,过滤; 把滤液分成两份。 | 产生白色沉淀 |
b.向一份滤液中滴加足量稀硝酸和硝酸银溶液。 | 产生白色沉淀 |
c.向另一份滤液中滴加硫酸铜溶液。 | 产生蓝色沉淀 |
请分析:
步骤a所得滤液中的溶质为____________;
步骤b证明样品中含有氯化钠,产生白色沉淀的化学方程式为_______;
样品(久置的工业烧碱)成分为_____________。
【答案】 > 溶液pH明显下降直至等于(或小于)7 碳酸钠 由于事先“向其中加入过量稀盐酸”,无法判断盐酸根是来自于盐酸还是原样品 硝酸钙、氢氧化钠、氯化钠、硝酸钠 NaCl + AgNO3![]() AgCl↓ + NaNO3 碳酸钠、氯化钠、氢氧化钠
AgCl↓ + NaNO3 碳酸钠、氯化钠、氢氧化钠
【解析】 (1). 由图可知a点所示溶液的pH大于7 (2). 溶液pH明显下降直至等于(或小于)7 ,证明氢氧化钠被反应掉; (3). 氢氧化钠放置时易变质生成碳酸钠,碳酸钠和盐酸反应生成二氧化碳产生气泡, (4). 盐酸和氯化钠都能与硝酸银反应生成氯化银沉淀,由于事先“向其中加入过量稀盐酸”,无法判断盐酸根是来自于盐酸还是原样品 (5). 加入过量硝酸钙溶液,和碳酸钠反应生成碳酸钙和硝酸钠,过滤后溶液中有硝酸钙、氢氧化钠、氯化钠、硝酸钠 (6).向一份滤液中滴加足量稀硝酸和硝酸银溶液,产生白色沉淀证明有氯化钠,反应方程式为: NaCl + AgNO3 →AgCl↓ + NaNO3 (7).向另一份滤液中滴加硫酸铜溶液。 产生蓝色沉淀 ,证明样品中有氯化钠,结合前边的验证,可知样品中有碳酸钠、氯化钠、氢氧化钠