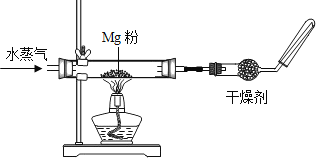
��Ŀ����
����Ŀ����һ��������̼��ط�ĩ���������ʿ���������ء�����ơ��Ȼ��ء��Ȼ�����̼�����е�һ�ֻ��֡�Ϊȷ����ɷ֣���������ʵ��:
��1��ȡ�����÷�ĩ���Թ��У���������ˮ����ܽ⣬�õ���ɫ������Һ�������Һ�м�����������������Һ���а�ɫ�����������ټ���������ϡ���ᣬ��ַ�Ӧ���ְ�ɫ������ʧ��
��2����ȡ13.8g �÷�ĩ���ձ��У���ˮʹ����ȫ�ܽ⣬�ټ���100gһ�����������������Ȼ�����Һ��ǡ����ȫ��Ӧ������19.7g��ɫ����������˵����ȷ����
A.�����п��ܺ����Ȼ���
B.������һ�������Ȼ��أ����ܺ�������ء�̼����
C.�����Ȼ�����Һ�����ʵ���������Ϊ20.8%
D.�ð���ĩ��������������
���𰸡�C
��������
ʵ��һ����������ˮ����ܽ��õ���ɫ������Һ��˵���÷�ĩһ�������Ȼ���������ƣ���Ϊ�Ȼ�����Һ�ǻ�ɫ�ģ����������̼��ط�Ӧ������ɫ������ʹ��Һ����ǡ������ڸ���Һ�м�����������������Һ���а�ɫ��������������������ϡ���ᣬ��ַ�Ӧ���ְ�ɫ������ʧ��˵���÷�ĩһ�������Ȼ��أ���Ϊ�Ȼ�������������Ӧ���ɲ���������Ȼ�������������������ij�����̼������̼�������������Ӧ����̼��������Ҳ���ܻ�����̼���ƺ�����ء���ˣ��Ӹ�ʵ���п�֪̼��ط�ĩ��һ�������Ȼ��أ����ܺ�������غ�̼���ƣ�һ�������Ȼ���������ơ�
ʵ�����13.8g �÷�ĩ��100gһ�����������������Ȼ�����Һ��ǡ����ȫ��Ӧ������19.7g��ɫ����������ʵ��һ��֪���ù�����һ�������ķ�Ӧ��̼��غ��Ȼ�����Ӧ�������ܷ����ķ�Ӧ��̼�������Ȼ�����Ӧ����֪��![]() ������13.8g �÷�ĩΪ̼��أ�������İ�ɫ����������ǡ��Ϊ19.7g����
������13.8g �÷�ĩΪ̼��أ�������İ�ɫ����������ǡ��Ϊ19.7g����![]() ������13.8g �÷�ĩΪ̼���ƣ�������İ�ɫ��������������19.7g���÷�ĩһ������̼��غ��Ȼ��أ���̼��ص�����С��13.8g����������������һ��ҲС��19.7g���ʸ÷�ĩ�л�һ����̼���ơ�
������13.8g �÷�ĩΪ̼���ƣ�������İ�ɫ��������������19.7g���÷�ĩһ������̼��غ��Ȼ��أ���̼��ص�����С��13.8g����������������һ��ҲС��19.7g���ʸ÷�ĩ�л�һ����̼���ơ�
A���Ȼ�����Һ�л�ɫ�ģ�����������һ���������Ȼ��������������⣻
B����ʵ�������֪��������һ�������Ȼ��غ�̼���ƣ����ܺ�������أ����������⣻
C�����Ȼ���������ΪX��
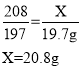
�����Ȼ�����Һ�����ʵ���������Ϊ![]() ���������⣻
���������⣻
D��ͨ��ʵ�������֪���ð���ĩ����������֣�̼��ء��Ȼ��غ�̼���ƣ�̼��ء��Ȼ��ء�̼���ƺ�����أ����������⡣��ѡC��

 53������ϵ�д�
53������ϵ�д�����Ŀ�����ܱ���������������������̼��ˮ������һ��δ֪����W����һ�������³�ַ�Ӧ����÷�Ӧǰ������ʵ����������ʾ��������˵������ȷ���ǣ�������
���� | ���� | ������̼ | ˮ���� | W |
��Ӧǰ����/g | 50 | 1 | 1 | 23 |
��Ӧ������/g | 2 | 45 | 28 | x |
A. ���������غ㶨�ɣ�x��ֵӦΪ2
B. �÷�Ӧ�����û���Ӧ
C. �÷�Ӧ�еĶ�����̼��ˮ������������Ϊ44��27
D. �÷�Ӧ������W��̼Ԫ�ص�����Ϊ10g