题目内容
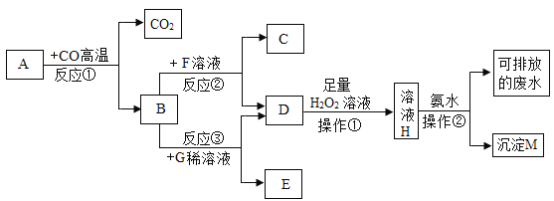
【题目】现有A~M七种物质,已知A是赤铁矿的主要成分,G的浓溶液稀释时会放出大量的热,F溶液为蓝色,它们之间存在如图所示的转化及相关操作:
查阅资料:Fe2(SO4)3,CuSO4,FeSO4均能与氨水反应生成沉淀,依次生成红褐色的氢氧化铁沉淀,蓝色的氢氧化铜沉淀,白色的氢氧化亚铁沉淀。
(1)工业上常利用反应①的原理来炼铁,写出反应①的化学方程式_____;
(2)反应②的化学方程式为_____;
(3)E与A也能发生反应,根据反应原理,判断E的性质为_____(氧化性或还原性)。
(4)利用G的稀溶液与A的反应在生活中用途为_____,A,D,H,M中相同金属元素的化合价_____ (相同或不同)。
(5)操作②的名称为_____。
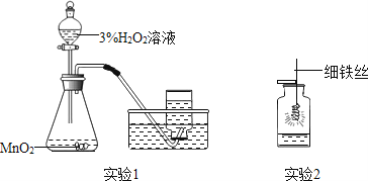
(6)已知沉淀M为红褐色沉淀,操作①中观察到的实验现象是_____,一个化学反应中元素的化合价有升高就必然有元素的化合价降低,则反应物H2O2反应后对应的产物_____(H2O或O2)。
【答案】Fe2O3+3CO![]() 2Fe+3CO2 Fe+CuSO4=FeSO4+Cu 还原性 除锈 不同 过滤 溶液由浅绿色变成黄色 H2O
2Fe+3CO2 Fe+CuSO4=FeSO4+Cu 还原性 除锈 不同 过滤 溶液由浅绿色变成黄色 H2O
【解析】
因为A是赤铁矿的主要成分,所以A是氧化铁;氧化铁和一氧化碳在高温下反应生成铁和二氧化碳,所以B是铁。G的浓溶液稀释时会放出大量的热,所以G是硫酸;铁和稀硫酸反应生成氢气和硫酸亚铁。F溶液为蓝色,所以F是硫酸铜,铁和硫酸铜反应生成铜和硫酸亚铁,所以C是铜,D是硫酸亚铁,E是氢气。硫酸亚铁与双氧水反应生成硫酸铁和水。加入氨水后,生成氢氧化铁沉淀和硫酸铵。
(1)氧化铁和一氧化碳反应生成铁和二氧化碳,化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(2)铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=FeSO4+Cu;
(3)氧化铁和氢气反应生成铁和水,在该反应中氢气的性质为还原性;
(4)氧化铁和稀硫酸反应生成硫酸铁和水,在生活中用途为除锈;A的化学式为:Fe2O3,Fe的化合价为+3价;D的化学式为:FeSO4,Fe的化合价为+2价;
H的化学式为Fe2(SO4)3,Fe的化合价为+3价;M的化学式为:Fe(OH)3,Fe的化合价为+3价;所以A,D,H,M中相同金属元素的化合价不同;
(5)把不溶性固体和液体相分离的操作叫过滤;
(6)硫酸亚铁溶液和过氧化氢溶液反应生成硫酸铁,现象是:溶液由浅绿色变成黄色;一个化学反应中元素的化合价有升高就必然有元素的化合价降低,铁的化合价由+2升高到+3,氧的化合价由-1降低到-2,则反应物H2O2反应后对应的产物是H2O。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】(4分)KNO3和KCl在不同温度时的溶解度如下表所示。请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | |
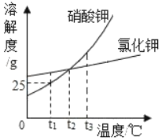
(1)依据上表数据,绘制KNO3和KCl的溶解度曲线,右图中能表示KNO3溶解度曲线的是 。(填m或n)
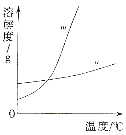
(2)由表中数据分析可知, KNO3和KCl在某一温度时具有相同的溶解度x,则x的取值范围是 。
(3)10℃时,131g 饱和KCl溶液,蒸发10g水后,再降温到10℃,可析出KCl晶体的质量为 。
(4)如右图所示,20℃时,将盛有饱和KNO3溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出。加入的物质可能是下列中的________(填字母序号)。
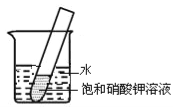
A.氢氧化钠固体 B.生石灰固体
C.冰块 D.硝酸铵固体
E.浓硫酸