题目内容
【题目】人类的生活和生产都离不开金属材料。
(1)铝制品具有抗腐蚀性的原因_____(用化学方程式表示)。
(2)制造飞机的材料大量使用了新型的铝锂合金,由图1可知,锂原子的核外电子数为_____,在化学反应中形成离子的符号是_____。
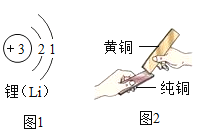
(3)钛酸锂(Li4Ti5O12)是制造锂电池的材料之一,其中锂、钛两种元素的质量比是_____(最简整数比)。
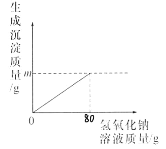
(4)黄铜是铜锌合金,将黄铜片和纯铜片互相刻划(如图2所示),纯铜片上留下明显的划痕,说明_____。
【答案】4Al+3O2=2Al2O3 3 Li+ 7:60 黄铜硬度比纯铜大
【解析】
(1)铝制品具有很好抗腐蚀性原因是铝易与空气中的氧气反应生成了致密的氧化铝薄膜,隔绝了内层的铝与氧气的接触,对内层的铝起保护作用,故反应的化学方程式表示为:4Al+3O2=2Al2O3。
(2)根据锂的原子结构示意图可知,锂原子核外的电子数为3,故填3;
根据锂的原子结构示意图可知,锂原子的核电荷数为3,最外层有1个电子,在化学反应易失去最外层的1个电子,形成带一个单位的正电荷,符号为:Li+。
(3)钛酸锂(Li4Ti5Ol2)是制造锂电池的材料之一,其中锂、钛两种元素的质量比是:(7×4):(48×5)=7:60,故填7:60。
(4)将纯铜片和黄铜片互相刻画,纯铜片上留下明显的划痕,说明黄铜的硬度比纯铜的硬度大,故填黄铜硬度比纯铜大。

【题目】MnO2不仅对氯酸钾的分解起到催化作用,对过氧化氢的分解也起到催化作用。写出加热氯酸钾与二氧化锰反应的文字表达式或化学方程式:_____。
某同学想:CuO能否起到类似MnO2的催化剂作用呢?于是进行了以下探究。
(猜想)I、CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;
II、CO参与反应产生O2,反应前后质量和化学质发生了改变;
Ⅲ、CuO是反应的催化剂,反应前后_____。
(实验)用天平称量0.2g CuO,取5mL5%的过氧化氢溶液于试管中,进行如下实验:

(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
_____ | _____ | _____ | 猜想Ⅰ、Ⅱ不成立; 猜想Ⅲ成立。 |
(2)步骤①的目的是_____。
(3)过氧化氢能被CuO催化分解产生O2的化学方程式为_____。