题目内容
【题目】相关研究将氯化钙搭载于分子筛上制备的复合吸附剂比单一吸附剂有更好的吸附性和稳定性。以石灰石(杂质主要是SiO2、MgSO4)为原料生产的流程如下图所示。
![]()
资料链接:①SiO2不溶于盐酸也不与盐酸反应。②MgSO4可溶于水。
(1)石灰石和盐酸反应的化学方程式为_____。
(2)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和_____。
(3)滤液1中加入适量的BaCl2溶液的作用是_____。
(4)滤液2中加入过量的Ca(OH)2可以除去HCl、_____。
(5)滤液3呈碱性,为使溶液pH降低,可加入适量的_____。
【答案】CaCO3+2HCl=CaCl2+H2O+CO2↑ 漏斗 除去MgSO4 MgCl2 HCl
【解析】
(1)石灰石的主要成分是碳酸钙,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和漏斗;
(3)氯化钡和硫酸镁反应生成硫酸钡沉淀和氯化镁,故向滤液1中加入适量的BaCl2溶液的作用是除去MgSO4;
(4)氯化镁、盐酸对于氯化钙来说,也是杂质;氯化镁与氢氧化钙反应生成氯化钙和氢氧化镁沉淀,盐酸与氢氧化钙反应生成氯化钙和水,滤液2中加入Ca(OH)2可以除去HCl、MgCl2;
(5)氢氧化钙溶液足量,故滤液3呈碱性,所以过滤后的溶液中含有氢氧化钙,可加入盐酸,盐酸和氢氧化钙反应生成氯化钙和水,可使溶液pH降低,又不引入新的杂质。

【题目】溶液与人们的生产生活密切相关。
(1)如表是KNO3在不同温度时的溶解度,回答问题。
温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | 202 |
90℃时,将一定质量的KNO3溶液按图1示进行操作:

90℃时的KNO3溶液是______(填“饱和”或“不饱和”)溶液。图中n的数值为______。
(2)请根据如图2中甲、乙、丙三种固体的溶解度曲线回答问题。
T3℃时,在各加有甲、乙、丙30克固体的三个烧杯中,分别倒入50克水,充分搅拌后,形成饱和溶液的是______当温度降低至T2℃时,此三杯溶液中溶质的质量分数由大到小的顺序为______。
T3℃时100克水中加入95克甲的固体,发现全部溶解,一段时间后又有部分甲的固体析出。“全部溶解”的原因可能是:______。
【题目】某课外活动小组进行如下实验探究。
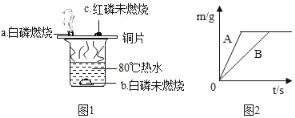
(1)验证物质的燃烧条件
根据图1进行实验,实验现象如图所示。
①80℃热水的作用是_____,_____。
②比较现象a、c,得出燃烧的条件是_____。
(2)①将一定质量的锌粒投入含有Cu(NO3)2和Fe(NO3)2的混合溶液中,充分反应后过滤,若滤液中只含一种溶质,则滤渣中一定含有_____。(填化学用语)
②在质量相等、溶质质量分数相同的稀硫酸中,分别加入等质量的锌粉和铁粉,生成氢气质量(m)随反应时间(t)的变化曲线如图2所示。下列表述不正确的是_____(填序号)。
①A表示锌和稀硫酸的反应曲线 ②反应结束后消耗两种金属的质量相等
③反应结束后两种金属一定都有剩余 ④反应结束后稀硫酸都没有剩余
⑤反应结束后生成的氢气质量相等。
(3)在AgNO3和Mg(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中滴入稀盐酸,有无色气体产生,则下列对滤渣和滤液的成分判断中,正确的是_____(填字母)。
A.滤液中溶质只有Fe(NO3)2 B.滤液中﹣定含有Fe(NO3)2和Mg(NO3)2
C. 滤渣中只有银 D.滤渣中一定含有银和铁
(4)科学家发现一种新金属。根据下表信息推测该金属不适合的用途是_____。
熔点 | 密度 | 强度 | 导电性 | 导热性 | 抗腐蚀性 |
2500℃ | 3g/cm3 | 与钢相似 | 良好 | 良好 | 优异 |
A.焊接金属 B.用于通讯设备 C.制造外科手术刀 D.制造航天飞机
(5)测定水中氢、氧元素的质量比。根据图3进行实验,反应后测得甲中玻璃管(含药品)质量减少ag,乙中U形管(含药品)质量增加bg。
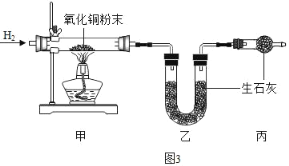
①水中氢、氧元素的质量比是_____(用含 a、b的式子表示)。
②下列因素中,对测定结果没有影响的是_____(填序号)。
A.CuO粉末不干燥 B.CuO没有完全转化为Cu C.没有丙装置
【题目】同学们对氯化氢与盐酸的化学性质是否相同进行如下探究(盐酸与氯化氢的甲苯溶液的微观示意图1、图2所示)

(提出问题)氯化氢气体与盐酸的化学性质是否相同?
(资料链接)
①氯化氢与甲苯不发生化学反应
②氯化氢气体也可溶于甲苯(一种有机溶剂),氯化氢的甲苯溶液中氯化氢以分子的形式存在。
③向浓盐酸中滴加浓硫酸,会有氯化氢逸出。
(分析与猜想)
(1)盐酸是氯化氢气体溶于水形成的溶液,在盐酸中存在氢离子、氯离子和_____________(填微粒符号)
(2)氯化氢与盐酸的化学性质可能不同,猜想的理由是___________。
(实验准备)制取氯化氢的甲苯溶液(如图3所示).
(1)B装置中浓硫酸的作用是什么?___.
(2)D中装有用实验室常见的某种物质浓溶液浸湿的棉花,其目的是除去尾气中的氯化氢,且该物质与氯化氢反应只生成盐和水。该物质可以是________(写化学式)
(进行实验)用盐酸和氯化氢的甲苯溶液进行对比实验。
现象 | 解释 | ||
与氧化铜 作用 | 盐酸:___________ | 化学方程式:_______ | |
氯化氢的甲苯溶液:无明显现象 | 氯化氢在甲苯中没有解离出氢离子 | ||
与紫色石蕊试剂作用 | 盐酸:紫色石蕊试剂变为红色 | ________________ | |
氯化氢的甲苯溶液:无明显现象 | 氯化氢在甲苯中没有解离出氢离子 | ||
(实验结论)氯化氢与盐酸气体的化学性质不同。