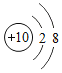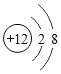题目内容
【题目】某同学欲除去粗盐中含有![]() 、
、![]() 、
、![]() 杂质制取精盐。操作流程如图:
杂质制取精盐。操作流程如图:
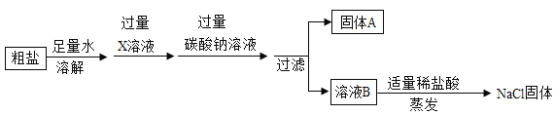
(1)写出X的化学式______________。(提示:微溶物不形成沉淀)
(2)写出加入碳酸钠溶液时反应的化学方程式____________。(写出一个即可)
(3)请设计实验方案证明溶液B中含有![]() 和
和![]() _________。(写出实验步骤和现象)
_________。(写出实验步骤和现象)
【答案】![]()
![]() [
[![]()
![]() 等] 取少量的溶液B,滴加足量的
等] 取少量的溶液B,滴加足量的![]() (或
(或![]() 等)溶液,有白色沉淀产生;静置(或过滤),向上层清液(或滤液)中滴加酚酞溶液,溶液变红
等)溶液,有白色沉淀产生;静置(或过滤),向上层清液(或滤液)中滴加酚酞溶液,溶液变红
【解析】
解:(1)镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加含钡离子的溶液之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,则X溶液为氢氧化钡溶液,其化学式为:Ba(OH)2;
(2)加入碳酸钠溶液,碳酸钠能与氢氧化钡溶液反应生成碳酸钡沉淀和氢氧化钠,碳酸钠能与氯化钙溶液反应生成碳酸钙沉淀和氯化钠,反应的化学方程式为:Ba(OH)2+Na2CO3═BaCO3↓+2NaOH、CaCl2+Na2CO3═CaCO3↓+2NaCl;
(3)计实验方案证明溶液B中含有Na2CO3和NaOH,碳酸钠和氢氧化钠均显碱性,应先证明碳酸钠的存在、再证明氢氧化钠的存在,可取溶液B少许于试管中,滴加足量的氯化钙溶液,产生白色沉淀,说明含有碳酸钠;过滤,向上层清液中滴加几滴无色酚酞溶液,变红色,说明含有氢氧化钠。

【题目】阅读资料并回答问题
钠(Na)是一种银白色金属,质软而轻,可用小刀切割,密度比水小,为 0.97g/cm3,熔点97.81℃,沸点 882.9℃。钠刚切开时,新切面有银白色光泽,但在空气中马上氧化转变为暗灰色。钠能与水发生剧烈反应生成氢氧化钠和氢气,量大时发生爆炸。钠还能在二氧化碳中燃烧,生成纯碱和一种气体氧化物。金属钠往往浸放于液体石蜡、矿物油和苯系物中密封保存。
(1)贮存金属钠时,用液体石蜡包裹的作用是______;
(2)金属钠在二氧化碳中燃烧的反应方程式是_______。铷(Rb)是一种银白色蜡状金属,化学性质与金属钠很相似,但比金属钠更活泼,遇水即在表面发生剧烈的反应并发生爆炸,该反应可表达为:
![]()
(3)推测溶液A中可能含有一种我们非常熱悉的离子____(填微粒符号),并设计3个不同的实验方案对此猜想进行验证。限选试剂:MgCl2溶液、CuSO4溶液、Na2CO3溶液、NaOH溶液、稀盐酸、酚酞溶液、紫色石蕊溶液、镁条、碳粉、氧化铁。
方案 | 验证预测的实验操作 | 预期现象 |
1 | 取少量溶液A于试管中,滴入____,振荡观察。 | 如果观察到___________则预测成立。 |
2 | 取少量溶液A于试管中,滴入____,振荡观察。 | 如果观察到___________则预测成立。 |
3 | 取少量溶液A于试管中,滴入_____,振荡观察。 | 如果观察到________________则预测成立。 |