题目内容
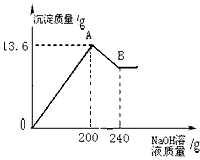
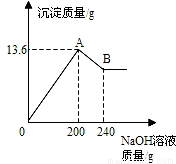
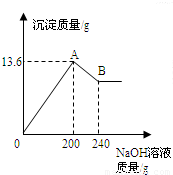
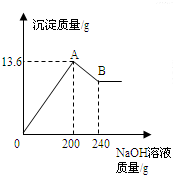
把MgCl2、AlCl3两种固体组成的混合物溶于足量的水后,在所得溶液中逐滴加入10%的NaOH溶液,加入NaOH溶液的质量和生成沉淀的质量如图所示,试回答:(提示:Al(OH)3+NaOH═NaAlO2+2H2O,NaAlO2可溶于水)(1)A点的沉淀物的化学式是______B点的沉淀物的化学式是______.
(2)原混合物中MgCl2的质量为______,AlCl3的质量为______.
【答案】分析:(1)向MgCl2、AlCl3两种物质的混合溶液中逐滴加入NaOH溶液,MgCl2、AlCl3与NaOH生成Mg(OH)2和Al(OH)3沉淀到恰好完全反应即图中A点;然后Al(OH)3沉淀与所加入的NaOH溶液继续发生反应Al(OH)3+NaOH═NaAlO2+2H2O,生成NaAlO2可溶于水而使沉淀质量减少,至图中B点时恰好完全反应,之后加入的NaOH溶液不再发生反应,沉淀质量不再改变;
(2)根据反应的化学方程式Al(OH)3+NaOH═NaAlO2+2H2O,由消耗NaOH的质量可计算13.6g混合沉淀物中的质量Al(OH)3,沉淀的总质量与沉淀Al(OH)3质量的差即生成Mg(OH)2沉淀的质量,然后分别根据生成两种沉淀反应的化学方程式,由两种沉淀的质量计算原混合物中MgCl2的质量、AlCl3的质量.
解答:解:(1)根据MgCl2、AlCl3与NaOH生成Mg(OH)2和Al(OH)3沉淀,可判断图中A点的沉淀物为Al(OH)3、Mg(OH)2的混合物;随后Al(OH)3沉淀与所加入的NaOH溶液继续发生反应Al(OH)3+NaOH═NaAlO2+2H2O,生成可溶于水的NaAlO2,因此图中B点的沉淀物全部为Mg(OH)2;
(2)据图,与氢氧化铝反应的氢氧化钠溶液质量为240g-200g=40g,设此时消耗氢氧化铝的质量为x
Al(OH)3+NaOH═NaAlO2+2H2O
78 40
x 40g×10%=4g
 =
=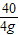
x=7.8g
设原混合物中AlCl3的质量为y,MgCl2的质量为z
AlCl3+3NaOH═Al(OH)3↓+3NaCl
133.5 78
y 7.8g
 =
=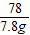 y=13.35g
y=13.35g
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
95 58
z 13.6g-7.8g=5.8g
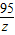 =
=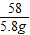
z=9.5g
故答案为:(1)Al(OH)3,Mg(OH)2;Mg(OH)2;
(2)9.5g;13.35g.
点评:在对表示反应的图象中的曲线进行分析时,抓住曲线起点、折点的特殊性,分析此时反应的发生情况对解决此类问题尤其重要.
(2)根据反应的化学方程式Al(OH)3+NaOH═NaAlO2+2H2O,由消耗NaOH的质量可计算13.6g混合沉淀物中的质量Al(OH)3,沉淀的总质量与沉淀Al(OH)3质量的差即生成Mg(OH)2沉淀的质量,然后分别根据生成两种沉淀反应的化学方程式,由两种沉淀的质量计算原混合物中MgCl2的质量、AlCl3的质量.
解答:解:(1)根据MgCl2、AlCl3与NaOH生成Mg(OH)2和Al(OH)3沉淀,可判断图中A点的沉淀物为Al(OH)3、Mg(OH)2的混合物;随后Al(OH)3沉淀与所加入的NaOH溶液继续发生反应Al(OH)3+NaOH═NaAlO2+2H2O,生成可溶于水的NaAlO2,因此图中B点的沉淀物全部为Mg(OH)2;
(2)据图,与氢氧化铝反应的氢氧化钠溶液质量为240g-200g=40g,设此时消耗氢氧化铝的质量为x
Al(OH)3+NaOH═NaAlO2+2H2O
78 40
x 40g×10%=4g
 =
=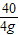
x=7.8g
设原混合物中AlCl3的质量为y,MgCl2的质量为z
AlCl3+3NaOH═Al(OH)3↓+3NaCl
133.5 78
y 7.8g
 =
=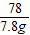 y=13.35g
y=13.35gMgCl2+2NaOH═Mg(OH)2↓+2NaCl
95 58
z 13.6g-7.8g=5.8g
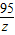 =
=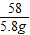
z=9.5g
故答案为:(1)Al(OH)3,Mg(OH)2;Mg(OH)2;
(2)9.5g;13.35g.
点评:在对表示反应的图象中的曲线进行分析时,抓住曲线起点、折点的特殊性,分析此时反应的发生情况对解决此类问题尤其重要.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
 把MgCl2、AlCl3两种固体组成的混合物溶于足量的水后,在所得溶液中逐滴加入10%的NaOH溶液,加入NaOH溶液的质量和生成沉淀的质量如图所示,试回答:(提示:Al(OH)3+NaOH═NaAlO2+2H2O,NaAlO2可溶于水)
把MgCl2、AlCl3两种固体组成的混合物溶于足量的水后,在所得溶液中逐滴加入10%的NaOH溶液,加入NaOH溶液的质量和生成沉淀的质量如图所示,试回答:(提示:Al(OH)3+NaOH═NaAlO2+2H2O,NaAlO2可溶于水)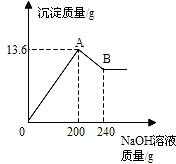 把MgCl2、AlCl3两种固体组成的混合物溶于足量的水后,在所得溶液中逐滴加入10%的NaOH溶液,加入NaOH溶液的质量和生成沉淀的质量如下图所示.已知:NaOH与AlCl3反应时,先使AlCl3全部转化为不溶于水的Al(OH)3,然后Al(OH)3还能继续与过量的NaOH发生如下反应:Al(OH)3+NaOH═NaAlO2+2H2O,其中NaAlO2 是可溶于水的物质,试回答:
把MgCl2、AlCl3两种固体组成的混合物溶于足量的水后,在所得溶液中逐滴加入10%的NaOH溶液,加入NaOH溶液的质量和生成沉淀的质量如下图所示.已知:NaOH与AlCl3反应时,先使AlCl3全部转化为不溶于水的Al(OH)3,然后Al(OH)3还能继续与过量的NaOH发生如下反应:Al(OH)3+NaOH═NaAlO2+2H2O,其中NaAlO2 是可溶于水的物质,试回答: