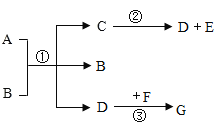
题目内容
【题目】有些晶体按比例带有一定量的结晶水,带有结晶水的晶体在一定温度下会脱去结晶水。草酸晶体(H2C204.xH2O)在常温下是一种无色透明晶体。草酸晶体受热分解时的化学方程式为H2C204.xH2O![]() (x+1)H20+CO2↑++CO↑。
(x+1)H20+CO2↑++CO↑。
某化学兴趣小组的同学利用该信息以及所学的知识设计并开展实验,测定草酸晶体中结晶水的质量分数。(图中固定装置已略去,装置气密性良好,装置A、B中的试剂足量,注射器量程足够)
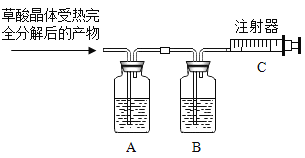
Ⅰ.测量装置A、B的质量,排尽注射器中的空气,连接装置;
II.取质量为m的草酸晶体,加热至完全分解,将产物全部通人以上装置;
Ⅲ.测量并记录装置A增加的质量为a,装置B增加的质量为 b,装置C读数为V;
Ⅳ.甲、乙、丙三位同学分别利用装置A、B、C所得数据计算该草酸晶体中结晶水的质量分数。
请回答下列问题:
(1)装置B的作用是_________;装置C的作用之一是测量____的体积。
(2)乙同学对利用装置B测量结果计算的可靠性进行反思与评价,认为反应后装置A中残留的气体会使自己的计算结果_______(填“偏小”或“偏大,,)。
(3)甲同学依据装置A测量结果计算结晶水的质量分数为________(用代数式表示)。
【答案】吸收生成的二氧化碳气体 一氧化碳(或![]() ) 偏大
) 偏大 ![]()
【解析】
(1)吸收生成的水蒸气应该用浓硫酸;吸收生成的二氧化碳气体用浓氢氧化钠溶液;最后剩余的一氧化碳气体进入注射器;
(2)因乙是根据生成的CO2来求结晶水的质量,而CO2已被A装置吸收了一部分,所以增加的质量b偏小,从而根据化学方程式算出的结晶水的质量也会偏大,最后算出结晶水的质量分数也当然偏大了;
(3)解:由题意可得:
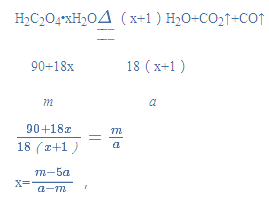
则结晶水的质量分数为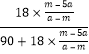 ×100%=
×100%=![]() ×100%。
×100%。

 阅读快车系列答案
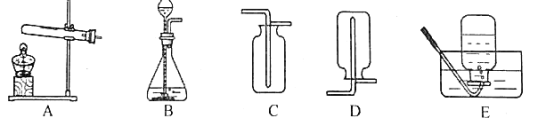
阅读快车系列答案【题目】利用下图所示装置可以进行实验室制备气体。
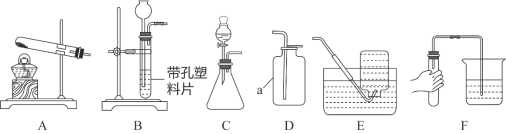
(1)实验室用KMnO4制备O2的化学方程式是______________________________。
(2)选择发生和收集O2的装置,填写在下表中(填字母)。
选用药品 | 发生装置 | 收集装置 |
H2O2溶液、MnO2 | ______ | 收集较纯净O2_______ |
KClO3、MnO2 | ______ | 收集较干燥O2______ |
(3)实验室用上述装置C制取CO2时,该反应生成二氧化碳中常混有少量氯化氢气体,某同学想通过图一装置探究是否有HCl气体,在广口瓶中盛放的试剂是硝酸银溶液,你认为混合气体应从__________(填“a”或“b”)进入。
![]()
(4)制取气体前应先检查的气密性,若按F图所示操作,结果在导管口未看到气泡,其可能原因与下列因素无关的是__________(选填编号)。
A.将烧杯换成水槽 B.将导管伸入水中位置过深,气体无法逸出
C.试管口橡皮塞未塞紧 D.先用手捂住试管,再将导管另一端插入水中
【题目】某同学在实验室发现一瓶由碳酸钠和氯化钠组成的混合溶液。为了测定此混合溶液中碳酸钠的质量分数,该同学设计如下实验:取此混合溶液53g,向其中滴加稀盐酸,当加入稀盐酸的质量为10g、20g、30g、40g时,生成气体的质量见下表(气体的溶解度忽略不计)。
第I组 | 第Π组 | 第Ⅲ组 | 第Ⅳ组 | |
稀盐酸的质量/g | 10 | 20 | 30 | 40 |
生成气体的质量/g | 0.9 | m | 2.2 | 2.2 |
请计算:
(1)第Π组数据m为_________;
(2)混合溶液中碳酸钠的质量分数是多少_____?