题目内容
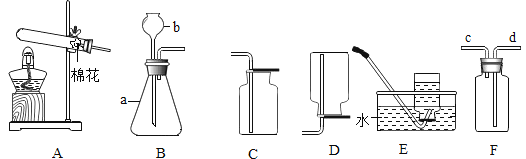
【题目】进行如下图所示微型实验,研究金属的性质。

(1)A中发生反应的化学方程式为____。
(2)C中铜不与硫酸亚铁溶液反应,其原因是____。
(3)若要验证铁、铜、银的金属活动性顺序,依据的现象是_____。
【答案】Fe+ CuSO4 =Cu + FeSO4 铁的金属活动性比铜强 A中铁的表面有红色的固体析出,B中铜的表面有银白色的固体析出
【解析】
(1)铁与硫酸铜反应生成硫酸亚铁和铜,反应的方程式为:Fe+ CuSO4 =Cu + FeSO4
(2)铁的金属活动性比铜强,故铜不能将铁从硫酸亚铁溶液中置换出来,故铜与硫酸铜不发生反应。
(3)A中铁的表面有红色的固体析出,说明铁比铜活泼,B中铜的表面有银白色的固体析出,说明铜比银活泼,故可以确定活动性顺序由强到若的顺序为:铁、铜、银。

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目