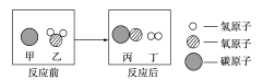
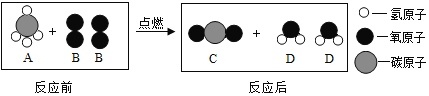
题目内容
【题目】对生活垃圾进行综合处理制备FeSO47H2O的流程如下:
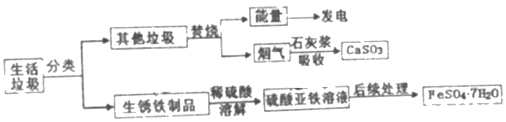
资料1:垃圾焚烧产生的烟气中含有SO2等有害气体
资料2:FeSO4容易被空气中的O2氧化
回答下列问题:
(1)将烟气直接排放,下雨时在空气中发生反应,形成_____ (填一 种大气污 染现象)。
(2)溶解步骤中发生的三个化学反应是:
① ②Fe+H2SO4 ═ FeSO4 +H2↑ ③Fe+ Fe2(SO4 )3 ═3 FeSO4
a、请写出①的化学反应方程式_____。
b、反应 Fe+ Fe2(SO4 )3 ═3 FeSO4的基本反应类型是_____。
c、溶解时能观察到的现象有固体溶解、溶液颜色改变和_____。
d.如果生锈铁制品中含有160Kg的Fe2O3,56Kg的Fe,理论上所有的铁元素都能转化成FeSO47H2O(相对分子质量为278),则得到FeSO47H2O的质量是_____kg。
(3)后续处理包括①将所得FeSO4溶液在氮气环境中蒸发溶剂浓缩、冷却结晶、过滤得到FeSO47H2O晶体;②用少量冰水洗涤2﹣3次滤出的FeSO47H2O晶体。其中氮气的作用是_____
【答案】酸雨 ![]() 化合反应 有气泡产生 834.16kg 隔绝空气,防止硫酸亚铁被氧化
化合反应 有气泡产生 834.16kg 隔绝空气,防止硫酸亚铁被氧化
【解析】
(1)垃圾焚烧产生的烟气中含有SO2等有害气体,将烟气直接排放,下雨时在空气中发生反应,形成酸雨;
(2)a、①为氧化铁和硫酸反应生成硫酸铁和水,①的化学反应方程式为![]() ;
;
b、反应![]() 是两种物质生成一种物质,属于化合反应;
是两种物质生成一种物质,属于化合反应;
c、铁能与硫酸反应产生气体,会观察到有气泡产生,所以溶解时能观察到的现象有固体溶解、溶液颜色改变和有气泡产生;
d、根据铁元素质量守恒可知,Fe2O3和Fe中的铁元素全部转化成FeSO4·7H2O,Fe2O3中的铁元素的质量为![]() ,FeSO4·7H2O中铁元素质量分数为
,FeSO4·7H2O中铁元素质量分数为![]() ,根据铁元素总质量可以求出得到FeSO4·7H2O的质量是
,根据铁元素总质量可以求出得到FeSO4·7H2O的质量是![]() ;
;
(3)氮气能隔绝空气,防止硫酸亚铁被氧气氧化,所以氮气的作用是隔绝空气,防止硫酸亚铁被氧化。

 名校课堂系列答案
名校课堂系列答案【题目】KCl和KNO3的溶解度表及溶解度曲线如图所示,下列说法不正确的是( )
温度/℃ | 20 | 30 | 40 | 50 | |
溶解度S/g | KCl | 34.0 | 37.0 | 40.0 | 42.6 |
KNO3 | 31.6 | 45.8 | 63.9 | 85.5 | |
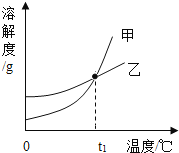
A. 甲表示KNO3溶解度曲线
B. 温度t1℃应在20~30℃之间
C. 40℃时,10gKC1加入20g水中,可得到33.3%的溶液
D. 50℃时,30gKNO3加入50g水,充分溶解,再降温到30℃,有晶体析出