题目内容
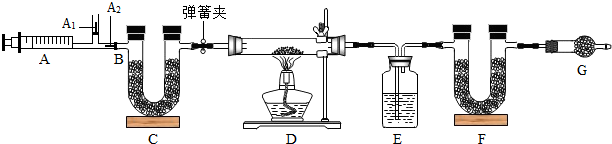
我国青海湖采集的天然碱样品可表示为aNa2CO3?bNaHCO3?cH2O(a.b.c为最简整数比).小红同学为测定其组成,称取该天然碱样品16.6g进行如图实验:
资料:
①许多物质从水溶液里析出晶体时,晶体里常含有一定数目的水分子,这样的水分子叫做结晶水.含有结晶水的物质叫做结晶水合物.
②天然碱样品(aNa2CO3?bNaHCO3?cH2O)是一种结晶水合物,受热时结晶水易失去;
③2NaHCO3
Na2CO3↑+CO2↑+H2O;
④碳酸钠比较稳定,加热时不分解.
⑤图中B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,A1 打开进空气,A2关闭.
【实验步骤】:①组装好装置,检查气密性 ②反复推拉注射器 ③称量E、F的质量④关闭弹簧夹,加热D处试管直到反应不再进行 ⑤打开弹簧夹,再次反复缓缓推拉注射器 ⑥再次称量E、F的质量.
【问题探究】:
(1)E中的药品为 ;C、F、G中装有碱石灰(CaO与NaOH的固体混合物)
G的作用是 .
(2)若不进行步骤⑤的操作,则所测得的碳酸氢钠质量分数 (填“偏大”、“偏小”、“无影响”),该操作中推注射器时缓缓的目的是 .
(3)请你根据下表数据计算:该天然碱样品16.6g中碳酸氢钠的质量(写出具体计算过程).
【交流与反思】:
(1)在计算碳酸氢钠的质量时,小红使用了甲组数据,而小华用了乙组数据,他们惊奇的发现两个人的计算结果不一样,请问你赞成 (填“小红”或“小华”)的计算结果,不赞成另一位同学的原因是: .
(2)最后确定16.6g天然碱样品中结晶水的质量为 g.

资料:
①许多物质从水溶液里析出晶体时,晶体里常含有一定数目的水分子,这样的水分子叫做结晶水.含有结晶水的物质叫做结晶水合物.
②天然碱样品(aNa2CO3?bNaHCO3?cH2O)是一种结晶水合物,受热时结晶水易失去;
③2NaHCO3
| ||
④碳酸钠比较稳定,加热时不分解.
⑤图中B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,A1 打开进空气,A2关闭.
【实验步骤】:①组装好装置,检查气密性 ②反复推拉注射器 ③称量E、F的质量④关闭弹簧夹,加热D处试管直到反应不再进行 ⑤打开弹簧夹,再次反复缓缓推拉注射器 ⑥再次称量E、F的质量.
【问题探究】:
(1)E中的药品为
G的作用是
(2)若不进行步骤⑤的操作,则所测得的碳酸氢钠质量分数
(3)请你根据下表数据计算:该天然碱样品16.6g中碳酸氢钠的质量(写出具体计算过程).
| 组别 | 反应前 | 反应后 |
| 甲 | E的质量为100.0克 | E的质量为102.25克 |
| 乙 | F的质量为50.0克 | F的质量为51.1克 |
(1)在计算碳酸氢钠的质量时,小红使用了甲组数据,而小华用了乙组数据,他们惊奇的发现两个人的计算结果不一样,请问你赞成
(2)最后确定16.6g天然碱样品中结晶水的质量为
考点:实验探究物质的组成成分以及含量,常见气体的检验与除杂方法,盐的化学性质,根据化学反应方程式的计算
专题:科学探究
分析:可以根据浓硫酸、碱石灰的性质方面判断实验过程中的相关方面的问题,根据具体的数据可以进行相关方面的计算,从而得出正确的结论.
解答:解;(1)E装置的作用是吸收水蒸气,浓硫酸能吸收水蒸气.故填:浓硫酸(浓H2SO4).
G的作用:防止空气中的二氧化碳和水蒸气等杂质气体进入到F中,影响二氧化碳质量的测定.故填:防止空气中的二氧化碳和水蒸气等杂质气体进入到F中,影响二氧化碳质量的测定;
(2)若不进行步骤⑤的操作,生成的二氧化碳和水不能被充分吸收,使得结果偏小.故填:偏小.
该操作中推注射器时缓缓的目的是使生成的二氧化碳、水蒸气吸收充分.故填;使生成的二氧化碳、水蒸气吸收充分.
(3)【交流与反思】:
(1)E的作用是吸收水蒸气,其中碳酸氢钠受热分解也生成水,所以不能用甲组数据;故填:小华;碳酸氢钠受热分解也生成水;
(2)根据表中的数据可知,反应后生成二氧化碳的质量为51.1g-50g=1.1g,设分解生成的水的质量为x,根据化学方程式
2NaHCO3
Na2CO3↑+CO2↑+H2O
44 18
1.1g x
=
x=0.45g
故天然碱中含有水的质量为102.25g-100.0g-0.45g=1.8g
答:16.6g天然碱样品中结晶水的质量为1.8g.
G的作用:防止空气中的二氧化碳和水蒸气等杂质气体进入到F中,影响二氧化碳质量的测定.故填:防止空气中的二氧化碳和水蒸气等杂质气体进入到F中,影响二氧化碳质量的测定;
(2)若不进行步骤⑤的操作,生成的二氧化碳和水不能被充分吸收,使得结果偏小.故填:偏小.
该操作中推注射器时缓缓的目的是使生成的二氧化碳、水蒸气吸收充分.故填;使生成的二氧化碳、水蒸气吸收充分.
(3)【交流与反思】:
(1)E的作用是吸收水蒸气,其中碳酸氢钠受热分解也生成水,所以不能用甲组数据;故填:小华;碳酸氢钠受热分解也生成水;
(2)根据表中的数据可知,反应后生成二氧化碳的质量为51.1g-50g=1.1g,设分解生成的水的质量为x,根据化学方程式
2NaHCO3
| ||
44 18
1.1g x
| 44 |
| 1.1g |
| 18 |
| x |
x=0.45g
故天然碱中含有水的质量为102.25g-100.0g-0.45g=1.8g
答:16.6g天然碱样品中结晶水的质量为1.8g.
点评:解答本题的关键是要充分理解物质的性质和实验目的,只有这样才能对问题做出正确的判断.

练习册系列答案
相关题目
现有H2和O2的混合气体10g,充分反应,恢复到室温,气体质量减少了9g,则混合气体中H2的质量最多为( )
| A、9g | B、8g | C、1g | D、2g |

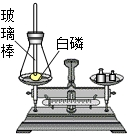 如图是测定白磷燃烧前后质量的变化情况,用来检验质量守恒的实验,试回答:
如图是测定白磷燃烧前后质量的变化情况,用来检验质量守恒的实验,试回答: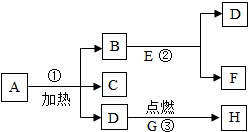
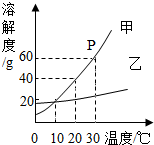 如图是甲乙两种固体物质的溶解度曲线,据图回答:
如图是甲乙两种固体物质的溶解度曲线,据图回答: