题目内容
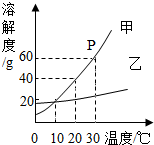 如图是甲乙两种固体物质的溶解度曲线,据图回答:
如图是甲乙两种固体物质的溶解度曲线,据图回答:(1)P点的含义是
(2)30℃时,将40g甲物质放入盛有50g水的烧杯中,所得溶液溶质的质量分数为
A.溶剂的质量 B.溶液的质量 C.溶质的质量分数 D.溶液状态
(3)当甲中含有少量乙时,可用
考点:固体溶解度曲线及其作用,结晶的原理、方法及其应用,有关溶质质量分数的简单计算
专题:溶液、浊液与溶解度
分析:(1)根据物质的溶解度曲线可以判断某一温度时,某种物质的溶解度大小;
(2)根据物质的溶解度可以计算形成溶液的溶质质量分数,也可以判断某些量的变化情况;
(3)一种物质的溶解度受温度变化影响较大,一种物质的溶解度受温度变化影响较小,可以用降温结晶的方法分离.
(2)根据物质的溶解度可以计算形成溶液的溶质质量分数,也可以判断某些量的变化情况;
(3)一种物质的溶解度受温度变化影响较大,一种物质的溶解度受温度变化影响较小,可以用降温结晶的方法分离.
解答:解:(1)P点的含义是30℃时,甲的溶解度是60g.
故填:30℃时,甲的溶解度是60g.
(2)30℃时,将40g甲物质放入盛有50g水的烧杯中,只有30g溶解,所得溶液溶质的质量分数为:
×100%=37.5%;
若将烧杯内物质升温至50℃时,
A.溶剂的质量一定不变;
B.溶液的质量增大;
C.溶质的质量分数增大;
D.溶液可能仍然是饱和溶液,也可能变成不饱和溶液.
故填:37.5%;A.
(3)甲的溶解度受温度变化影响较大,乙的溶解度受温度变化影响较小,当甲中含有少量乙时,可用降温结晶的方法提纯甲.
故填:降温结晶.
故填:30℃时,甲的溶解度是60g.
(2)30℃时,将40g甲物质放入盛有50g水的烧杯中,只有30g溶解,所得溶液溶质的质量分数为:
| 30g |
| 30g+50g |
若将烧杯内物质升温至50℃时,
A.溶剂的质量一定不变;
B.溶液的质量增大;
C.溶质的质量分数增大;
D.溶液可能仍然是饱和溶液,也可能变成不饱和溶液.
故填:37.5%;A.
(3)甲的溶解度受温度变化影响较大,乙的溶解度受温度变化影响较小,当甲中含有少量乙时,可用降温结晶的方法提纯甲.
故填:降温结晶.
点评:溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同.

练习册系列答案
相关题目
生活中发生的下列变化,属于物理变化的是( )
| A、煤气燃烧 | B、铁被磁化 |
| C、菜刀生锈 | D、牛奶变酸 |
 图中,甲为某元素在周期表中的相关信息,乙为其原子结构示意图.
图中,甲为某元素在周期表中的相关信息,乙为其原子结构示意图.