题目内容
【题目】某兴趣小组的同学对酸的化学性质进行探究、总结及应用:
(1)酸的化学性质①—与酸碱指示剂作用。酸能使石蕊溶液变_____色,不能使酚酞溶液变色。
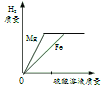
(2)酸的化学性质②—与 M反应。M所代表的物质类别是_____。小思为测定某假黄金 (铜锌合金)的成分,将60g稀盐酸分三次加入到盛有10g该样品的烧杯中,所得数据如表。由此______(填“能”或“不能”)得出该样品中锌的质量分数。
实验次数 | 1 | 2 | 3 |
加入稀盐酸质量/g | 20 | 20 | 20 |
充分反应后剩余固体质量/g | 8.7 | 7.4 | 6.4 |
(3)酸的化学性质③—与金属氧化物反应。盐酸除铁锈,化学方程式为_______。
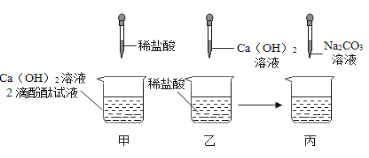
(4)酸的化学性质④—与碱反应。小成向氢氧化钠溶液中滴加稀硫酸,后发现忘了加指示剂。同学们对所得溶液含有哪些溶质展开了讨论。
[提出猜想]猜想一:溶质是 Na2SO4;猜想二:溶质是Na2SO4和NaOH;猜想三:溶质是______。
[实验探究]小良同学设计如下的实验方案:
方法步骤 | 实验现象 | 实验结论 | |
方案一 | 取所得溶液少量于试管中,滴入几滴酚酞溶液 | 酚酞不变红色 | 猜想一正确猜想二不正确 |
方案二 | 取所得溶液少量于试管中,滴加BaCl2溶液 | 出现白色沉淀 | 猜想三正确 |
方案三 | 取所得溶液少量于试管中,加少量CuO,振荡 | _____ | 猜想三正确 |
[方案评价]同学们讨论后认为:
①方案一存在缺陷,不能证明猜想一是正确的,原因是_______。
②方案二也不能证明猜想三是正确的,理由是_______。
③方案三正确,而且还可以向溶液中加入活泼金属、碳酸盐等物质进行证明。
[实验反思]在分析化学反应后所得物质成分时,还需考虑______/span>。
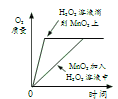
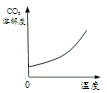
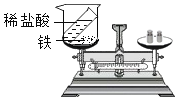
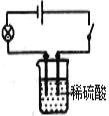
[学科渗透]如图,将电极两端插入稀 H2SO4溶液中,闭合开关,灯泡正常发光, 然后逐滴加入Ba(OH)2溶液至过量,灯泡的发光情况为______。
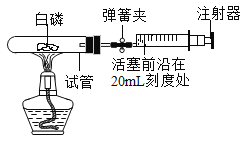
(5)酸的化学性质⑤—酸与盐的反应。利用如图装置证明CO2与 NaOH溶液能发生反应,可先加氢氧化钠溶液,再加盐酸,气球的变化是______。
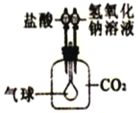
[方法感悟]化学实验可通过验证生成物的存在,来验证化学反应的发生。
【答案】红 金属单质 能 Fe2O3+6HCl=2FeCl3+3H2O Na2SO4和H2SO4 固体逐渐溶解,溶液变为蓝色 酚酞在酸性和中性条件下都不变色,故可能含有稀硫酸 溶液中一定含有硫酸钠,可以与氯化钡反应,生成硫酸钡白色沉淀,不能确定是否含有稀硫酸 反应物是否有过剩 先变暗至熄灭,后又变亮 气球先变瘪,后涨大
【解析】
(1)紫色石蕊遇酸会变成红色。
(2)由实验方案可知,M是金属单质。由表可知,该样品中铜的含量为6.4g,故可以计算出锌的质量分数。
(3)稀盐酸与氧化铁反应生成氯化铁和水,反应的方程式为:Fe2O3+6HCl=2FeCl3+3H2O
(4)当硫酸过量时,溶液中的溶质有硫酸钠和硫酸。故猜想为:Na2SO4和H2SO4。稀硫酸可以和氧化铜反应生成硫酸铜和水,故现象是固体逐渐溶解,溶液变为蓝色。
[方案评价]
①酚酞在酸性和中性条件下都不变色,故可能含有稀硫酸,故错误;
②溶液中一定含有硫酸钠,可以与氯化钡反应,生成硫酸钡白色沉淀,不能确定是否含有稀硫酸。
[实验反思]
探究反应后溶液的溶质时,除了要考虑生成物,而且要考虑反应物是否有过剩。
[学科渗透]
溶液导电的原因是由于溶液中含有可以自由移动的离子,当加入氢氧化钡时,与稀硫酸反应生成水和硫酸钡,溶液中的离子含量逐渐减少至0,当氢氧化钡过量时,又含有了离子,故灯泡的发光情况为先变暗至熄灭,后又变亮。
(5)氢氧化钠与二氧化碳反应 ,瓶内气压降低,气球涨大,当加入稀盐酸时,稀盐酸与碳反应生成二氧化碳气体,瓶内气压增加,气球变瘪,故填:气球先涨大,后变瘪。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】某研究小组发现,维C泡腾片(保健药品,主要成分见图1)溶于水,有许多气泡产生(如图2)。该小组同学对该气体的成分进行如下探究:
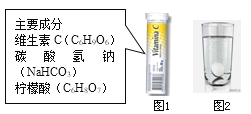
(猜想与假设)小华说:该气体可能是CO2、O2、CO、H2、N2。
(1)小明说:不可能含有N2,因为_____。
(2)小芳说:不可能含有CO和H2,因为从药品安全角度考虑,H2易燃易爆,CO_____。该小组同学认为:该气体可能含有CO2、O2中的一种或两种。
(进行实验)
实验编号 | 实验操作 | 实验现象 |
① | 将气体通入澄清的石灰水中 | 澄清石灰水变浑浊 |
② | 将带火星的木条伸入该气体中 | 带火星的木条没有复燃 |
(得出结论)(3)由实验①可知,该气体中肯定含有_____,写出该反应的化学方程式_____。
(4)由实验②_____(填“能”或“不能”)确定该气体中不含氧气,理由是_____。