题目内容
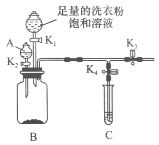
【题目】(5分)镀锌铁片是在铁片上均匀镀上一层锌。某小组为测定10g镀锌铁片上锌的质量,设计方案如下:
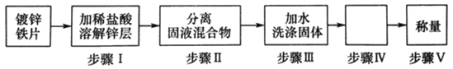
⑴步骤Ⅰ中溶解锌的化学方程式为__________________________________,步骤Ⅲ洗涤的目的是为了除去___________________________________,步骤Ⅳ是______________________;
⑵利用上述方案进行实验,测定结果偏大,分析原因。
⑶若将方案中的稀盐酸换成硫酸亚铁溶液,为达到实验目的,写出步骤Ⅰ中的具体操作。
【答案】(1)①Zn+2HCl=ZnCl2+H2↑ ②铁片表面残留的氯化锌溶液 ③干燥
(2)实际操作中不容易判断锌层恰好完全被酸溶解,稀盐酸会稍过量,铁与盐酸反应,反应后称量的铁片的质量会低于实际值
(3)先将镀锌铁片研碎,加入足量的硫酸亚铁溶液,充分反应后溶液颜色仍呈浅绿色(或直接加入硫酸亚铁溶液后不断搅拌、充分振荡也可)
【解析】
试题分析:(1)步骤Ⅰ中溶解锌是加入稀盐酸,故化学方程式为:Zn+2HCl=ZnCl2+H2↑,步骤Ⅲ洗涤的目的是为了除去:铁片表面残留的氯化锌溶液,步骤Ⅳ是干燥
(2)利用上述方案进行实验,测定结果偏大,其原因是:实际操作中不容易判断锌层恰好完全被酸溶解,稀盐酸会稍过量,铁与盐酸反应,反应后称量的铁片的质量会低于实际值
(3)将方案中的稀盐酸换成硫酸亚铁溶液,实际就是利用反应原理:FeSO4+Zn==ZnSO4+Fe,这样就不存在会继续与铁反应的这种情况,但为了是反应充分进行,故应先将先将镀锌铁片研碎,加入足量的硫酸亚铁溶液,充分反应后溶液颜色仍呈浅绿色(或直接加入硫酸亚铁溶液后不断搅拌、充分振荡也可

【题目】取10克锌粉和铜粉的混合物与烧杯中,向烧杯中加入等质量的同种稀硫酸,实验过程中得到的数据如下。
(1)写出实验过程中发生反应的化学方程式:
(2)混合物中铜粉的质量是 。
(3)计算所用稀硫酸中溶质的质量分数。
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀硫酸的质量 | 20g | 20g | 20g | 20g |
剩余固体的质量 | 8.7g | 7.4g | 6.1g | 5.5g |