题目内容
某碱厂的主要产品之一是小苏打(碳酸氢钠),为了测定产品中碳酸氢钠的质量分数(假设该样品中只含氯化钠一种杂质).取样品10.0g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如下图所示.(有关反应:NaHCO3+HCl=NaCl+H2O+CO2↑)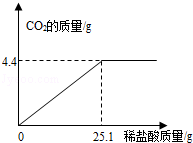
求:(1)样品中碳酸氢钠的质量分数.
(2)恰好完全反应时,所得溶液中溶质的质量分数.
84%;24.3%
解析试题分析:设样品中碳酸氢钠的质量为x,生成氯化钠的质量为y
NaHCO3+HCl=NaCl+H2O+CO2↑
84 58.5 44
x y 4.4g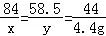
x=8.4g
y=5.85g
样品中碳酸氢钠的质量分数=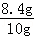 ×100%=84%
×100%=84%
恰好完全反应时,所得溶液中溶质的质量分数=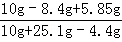 ×100%=24.3%
×100%=24.3%
答:(1)样品中碳酸氢钠的质量分数约为84%;
(2)恰好完全反应时,所得溶液中溶质的质量分数为24.3%
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.

练习册系列答案
相关题目
现有铜与另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,现欲测定其组成.
【查阅资料】(1)镁、铁、锌皆能与稀硫酸发生置换反应,且生成+2价的可溶性金属硫酸盐和氢气.
(2)相对原子质量:Mg﹣24、Fe﹣56、Zn﹣65
【实验步骤及数据】取该混合物粉末8.0g放入烧杯中,将140.0g 14.0%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如下:
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 35.O | 35.0 | 35.O | 35.O |
| 剩余固体的质量/g | 6.8 | 5.6 | 4.4 | 4.2 |
通过计算(写出计算过程),求:
(1)该混合物粉末中铜的质量分数?
(2)该混合物粉末中另一金属为何种金属?
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?

 CaO+ CO2↑
CaO+ CO2↑ 
 C2H4+4H2O.若用24g H2转化CO2,则理论上能生成C2H4的质量为多少克?
C2H4+4H2O.若用24g H2转化CO2,则理论上能生成C2H4的质量为多少克?