��Ŀ����
����ͭ����һ�ֽ����Ļ�����ĩ����һ�ֽ���������þ������п�е�һ�֣������ⶨ����ɣ�
���������ϡ���1��þ������п������ϡ���ᷢ���û���Ӧ��������+2�۵Ŀ����Խ��������κ�������
��2�����ԭ��������Mg��24��Fe��56��Zn��65
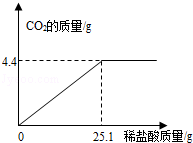
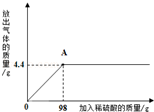
��ʵ�鲽�輰���ݡ�ȡ�û�����ĩ8.0g�����ձ��У���140.0g 14.0%��ϡ������Ĵμ�����ձ��У���ַ�Ӧ���ʣ������������ݼ�¼���£�
| ���� | 1 | 2 | 3 | 4 |
| ����ϡ���������/g | 35��O | 35.0 | 35��O | 35��O |
| ʣ����������/g | 6.8 | 5.6 | 4.4 | 4.2 |
ͨ�����㣨д��������̣�����
��1���û�����ĩ��ͭ������������
��2���û�����ĩ����һ����Ϊ���ֽ�����
��3�������μ��������ַ�Ӧ��������Һ�����ʵ����������Ƕ��٣�
�û�����ĩ��ͭ������������52.5%���û�����ĩ����һ����Ϊ����þ�������μ��������ַ�Ӧ��������Һ�����ʵ�����������16.6%��
���������������1���������Cu����������=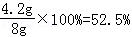
��2����ý���M�����ԭ������ΪX����4�η�Ӧ��ϡ��������Ϊ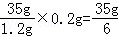
��Ӧ����ϡ����������35g��3+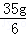 =
=
M+H2SO4�TMSO4+H2��
X 98
8g��4.2g  ��14%
��14%
X��98=3.8g��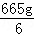 ��14%
��14%
X=24
���Ըý�����þ��
��3����������Һ��MgSO4������Ϊy������H2������Ϊz
Mg+H2SO4 �TMgSO4+H2��
98 120 2
105g��14% y z
98��120�T105g��14%��y y=18g
98��2�T105g��14%��z z=0.3g
MgSO4��Һ����������Ϊ18g/��105g+3.6g��0.3g����100%��16.6%
�𣺸û�����ĩ��ͭ������������52.5%���û�����ĩ����һ����Ϊ����þ�������μ��������ַ�Ӧ��������Һ�����ʵ�����������16.6%��
���㣺���ݻ�ѧ��Ӧ����ʽ�ļ��㣻�й��������������ļ��㣻�����Ļ�ѧ���ʣ�