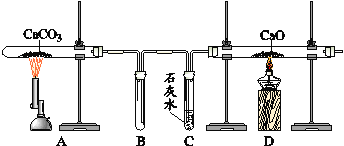
题目内容
【题目】工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。为了测定铁红中铁的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析。
【资料1】草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O4·3H2O![]() CO2↑+CO↑+4H2O
CO2↑+CO↑+4H2O
(1)下列可用作草酸分解制取气体的装置是 (填字母编号)。

【资料2】碱石灰是氢氧化钠和氧化钙的混合物,可以吸收水分和二氧化碳;
【资料3】浓硫酸具有吸水性,可以干燥气体;
【资料4】氢氧化钠溶液和石灰水类似都可以与二氧化碳反应,但吸收能力比石灰水强
【问题讨论】用下图所示装置进行实验:
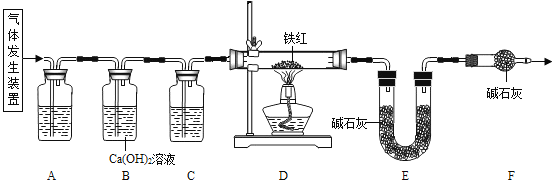
(2)实验前应先 。
(3)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是 (填字母编号)。
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(4)B装置的作用是 。
(5)写出D装置中所发生反应的一个化学方程式 。
【数据分析与计算】
【资料5】铁的常见氧化物中铁的质量分数:
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
(6)称取铁红样品10.0 g,用上述装置进行实验,测定铁红中铁的质量分数。
①D中充分反应后得到Fe粉的质量为m g,则 < m < 。
②待充分反应、冷却后,将D中的固体放入足量的稀硫酸溶液中,产生氢气质量为0.27g,则此铁红样品中铁的质量分数是多少?[写出详细计算过程]
【实验评价】
(7)反思:请指出【问题讨论】中实验装置的一个明显缺陷 。
【答案】(1)d;
(2)检查装置的气密性;
(3)c;a;
(4)验证二氧化碳是否除尽;
(5)3CO+Fe2O3![]() 2Fe+3CO2;
2Fe+3CO2;
(6)①7.0;7.78;
②设生成0.27g氢气需要铁的质量为x
Fe+H2SO4=FeSO4+H2↑
56 2
x 0.27g
56:2=x:0.27g
x=7.56g
则此铁红样品中铁的质量分数是:7.56g÷10.0g×100%=75.6%
答:此铁红样品中铁的质量分数是75.6%。
(7)缺少尾气处理装置。
【解析】
试题分析:(1)该反应是草酸晶体(H2C2O43H2O)在浓硫酸在加热条件下进行,故应选用d装置;
(2)实验前应先检查装置的气密性;
(3)一般用氢氧化钠溶液吸收二氧化碳,用澄清的石灰水检验,还可以检验二氧化碳是否除尽,可以用浓硫酸干燥一氧化碳;故A、C中的试剂依次是c、a;
(4)B装置的作用是检验二氧化碳是否除尽;
(5)D装置中所发生的化学反应是一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,化学方程式为:3CO+Fe2O3![]() 2Fe+3CO2;
2Fe+3CO2;
(6)①如果全部是氧化铁,得到铁的最少量是10g×70%=7.0g,如果全部是氧化亚铁,得到铁的最大量是10g×77.8%=7.78g;故7.0g<m<7.78g;
②根据氢气的质量,利用化学方程式计算出铁的质量,然后除以铁红的质量即可;
设生成0.27g氢气需要铁的质量为x
Fe+H2SO4=FeSO4+H2↑
56 2
x 0.27g
56:2=x:0.27g
x=7.56g
则此铁红样品中铁的质量分数是:7.56g÷10.0g×100%=75.6%
(7)一氧化碳有毒,不能直接排放到空气中,所以该实验装置的一个明显缺陷是缺少尾气处理装置。