题目内容
【题目】学习化学使我们的思维更加严谨,请你阅读图表和材料回答问题。
(1)图为元素周期表中的一格

请写出一条从图中你能获取的相关信息 。
(2)在点燃条件下,A和B反应生成C和D。反应前后分子变化的微观示意图如下

①1个B分子中含有__ __个原子。
②4种物质中,属于化合物的是___ __(填图中字母)。
③在该反应中,生成C和D的质量比为___ __(计算结果用最简整数比表示)。
(3)材料:Cl2化学性质很活泼,具有较强的氧化性,能与多种金属和非金属直接化合
氢气和氯气的混合气点燃或强光照射时发生爆炸。则氢气和氯气生成氯化氢气体的反应从能量变化(“吸热反应”或“放热反应”)和基本反应类型角度分类,分别属于 ; 。
通过上述实验,你对燃烧有什么新的认识? 。
【答案】(1)钙元素的相对原子质量为40.08等合理说法;
(2)①2;②AD;③14:27;
(3)放热反应;化合反应;燃烧不一定要氧气参加。
【解析】
试题分析:(1)据元素周期表中的一个小格所提供的信息:元素名称、符号、原子序数、相对原子质量,写出其中一个即可;故答案为:钙的原子序数为20,钙的相对原子质量为40.08等;
(2)①由图示可知1个B分子中含有2个氧原子;
②由图示可知A、D两种物质的分子是由不同原子构成的分子,则A、D属于化合物;
③根据图示可知,该反应是氨气和氧气反应生成氮气和水,化学方程式为4NH3+3O2![]() 2N2+6H2O,则生成C和D的质量比为(2×2×14):(6×18)=14:27;
2N2+6H2O,则生成C和D的质量比为(2×2×14):(6×18)=14:27;
(3)根据题中信息:氢气和氯气的混合气点燃或强光照射时发生爆炸,说明该反应是放热反应;反应物是氢气和氯气两种物质,生成物只有氯化氢气体一种物质,符合多对一的特征,是化合反应;通过上述实验,可认识到燃烧不一定要氧气参加。

【题目】工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。为了测定铁红中铁的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析。
【资料1】草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O4·3H2O![]() CO2↑+CO↑+4H2O
CO2↑+CO↑+4H2O
(1)下列可用作草酸分解制取气体的装置是 (填字母编号)。

【资料2】碱石灰是氢氧化钠和氧化钙的混合物,可以吸收水分和二氧化碳;
【资料3】浓硫酸具有吸水性,可以干燥气体;
【资料4】氢氧化钠溶液和石灰水类似都可以与二氧化碳反应,但吸收能力比石灰水强
【问题讨论】用下图所示装置进行实验:
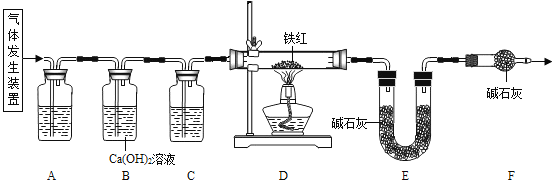
(2)实验前应先 。
(3)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是 (填字母编号)。
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(4)B装置的作用是 。
(5)写出D装置中所发生反应的一个化学方程式 。
【数据分析与计算】
【资料5】铁的常见氧化物中铁的质量分数:
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
(6)称取铁红样品10.0 g,用上述装置进行实验,测定铁红中铁的质量分数。
①D中充分反应后得到Fe粉的质量为m g,则 < m < 。
②待充分反应、冷却后,将D中的固体放入足量的稀硫酸溶液中,产生氢气质量为0.27g,则此铁红样品中铁的质量分数是多少?[写出详细计算过程]
【实验评价】
(7)反思:请指出【问题讨论】中实验装置的一个明显缺陷 。