题目内容
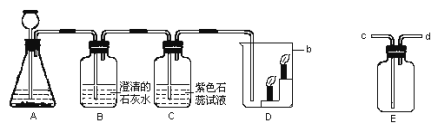
【题目】根据下列实验回答问题。

(1)A实验说明水是由 组成的。
(2)B实验中的主要现象是 。
(3)C实验说明白磷燃烧需要 和 条件。
(4)D中发生反应的化学方程式为 。
(5)E实验说明CO2具有 和 性质。
(6)F实验可说明 。
【答案】(1)氢元素和氧元素;(2)剧烈反应,并有大量气泡生成;(3)与氧气接触;温度达到白磷的着火点;(4)4P+5O2![]() 2P2O5;(5)密度比空气大;不燃烧也不支持燃烧;(6)黄铜比纯铜的硬度大。
2P2O5;(5)密度比空气大;不燃烧也不支持燃烧;(6)黄铜比纯铜的硬度大。
【解析】
试题分析:(1)A实验是电解水的实验,生成了氢气和氧气,说明水是由氢元素和氧元素组成的;
(2)B实验是镁与稀盐酸的反应,主要现象是剧烈反应,并有大量气泡生成;
(3)在C实验中,由水中白磷不燃烧而铜片上的白磷能燃烧,说明了白磷燃烧需要与氧气接触,由铜片上的白磷能燃烧而红磷不能燃烧,说明了白磷燃烧需要温度达到白磷的着火点;
(4)在D中红磷燃烧生成了五氧化二磷,反应的方程式是:4P+5O2![]() 2P2O5;
2P2O5;
(5)E实验中,下面的蜡烛先熄灭,上面的蜡烛后熄灭.说明二氧化碳密度比空气大,二氧化碳不燃烧也不支持燃烧;
(6)在F中,黄铜在纯铜上刻划能留下刻痕,说明黄铜比纯铜的硬度大。

【题目】(6分)用下图所示装置,分别对燃烧条件和CO2与水反应的实验进行研究。
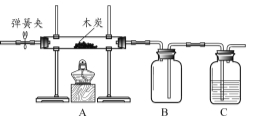
内容 | 【实验1】研究燃烧条件 | 【实验2】研究CO2与水反应 |
步骤 | ①打开弹簧夹,通入一段时间N2,关闭弹簧夹,加热木炭。 ②停止加热,冷却后打开弹簧夹,通入O2。 | ①向B中放入一朵用紫色石蕊溶液浸泡后干燥的纸花。 ②打开弹簧夹,通入O2。 |
③加热木炭。 ④停止通O2、熄灭酒精灯。 | ||
(1)木炭充分燃烧时,发生反应的化学方程式为 。
(2)实验1中,步骤①的目的是 ;步骤②的目的是 。
(3)实验2中,步骤①的目的是 ;C装置中的液体是 。
(4)两个实验中,B装置的共同作用是 。
【题目】工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。为了测定铁红中铁的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析。
【资料1】草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O4·3H2O![]() CO2↑+CO↑+4H2O
CO2↑+CO↑+4H2O
(1)下列可用作草酸分解制取气体的装置是 (填字母编号)。

【资料2】碱石灰是氢氧化钠和氧化钙的混合物,可以吸收水分和二氧化碳;
【资料3】浓硫酸具有吸水性,可以干燥气体;
【资料4】氢氧化钠溶液和石灰水类似都可以与二氧化碳反应,但吸收能力比石灰水强
【问题讨论】用下图所示装置进行实验:
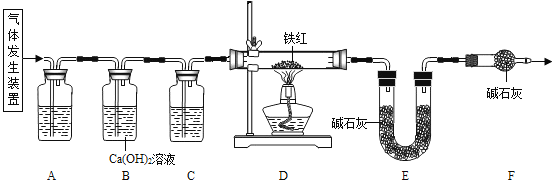
(2)实验前应先 。
(3)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是 (填字母编号)。
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(4)B装置的作用是 。
(5)写出D装置中所发生反应的一个化学方程式 。
【数据分析与计算】
【资料5】铁的常见氧化物中铁的质量分数:
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
(6)称取铁红样品10.0 g,用上述装置进行实验,测定铁红中铁的质量分数。
①D中充分反应后得到Fe粉的质量为m g,则 < m < 。
②待充分反应、冷却后,将D中的固体放入足量的稀硫酸溶液中,产生氢气质量为0.27g,则此铁红样品中铁的质量分数是多少?[写出详细计算过程]
【实验评价】
(7)反思:请指出【问题讨论】中实验装置的一个明显缺陷 。