题目内容
【题目】某同学从定量角度研究双氧水制取氧气的过程,对原实验进行部分改进,增加了称量操作。具体做法是:取 10%的双氧水和少量的二氧化锰放入气体发生装置,并对反应前后混合物的质量进行称量,记录如下:
反应过程 | 反应前 | 反应后 |
混合物质量(不含容器质量) | 68.6g | 65.4g |
若反应后,双氧水分解完全且氧气全部逸出,不计水分的蒸发,请完成下列问题:
①产生的氧气的质量为_______克。
②反应前过氧化氢的物质的量(根据化学方程式列式计算)_______。
③二氧化锰的作用是_______。
④根据上述数据,还可以确定的是_______。
a 二氧化锰的质量 b 双氧水溶液的质量 c 反应后溶液中水的质量
【答案】3.2 0.2mol 催化 abc
【解析】
过氧化氢在二氧化锰催化作用下生成水和氧气。
①根据质量守恒定律,反应物的总质量等于生成物的总质量,减少的为生成的氧气的质量,故产生的氧气的质量为![]() 。
。
②设反应前过氧化氢的质量为x
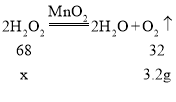
![]()
![]()
故反应前过氧化氢的物质的量为![]()
③二氧化锰在反应前后质量和化学性质不变,故二氧化锰的作用是催化作用。
④a、过氧化氢的质量为6.8g,则10%的双氧水的质量为![]() ,二氧化锰的质量为
,二氧化锰的质量为![]() ,则可以确定二氧化锰的质量,故a正确;
,则可以确定二氧化锰的质量,故a正确;
b、过氧化氢的质量为6.8g,则10%的双氧水的质量为![]() ,可以确定双氧水溶液的质量,故b正确;
,可以确定双氧水溶液的质量,故b正确;
c、反应后溶液中水的质量为![]() ,可以确定反应后溶液中水的质量,故c正确。故选abc。
,可以确定反应后溶液中水的质量,故c正确。故选abc。

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目