题目内容
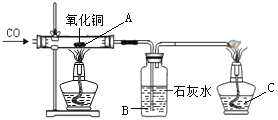
【题目】小明在课外阅读中得知:氢氧化铜受热会分解生成氧化铜,反应的化学方程式为Cu(OH)2![]() CuO +H2O,于是用CuSO4溶液与NaOH溶液反应制取氢氧化铜,然后对氢氧化铜进行加热,并用如图所示的装置用一氧化碳还原氢氧化铜完全分解得到的氧化铜。
CuO +H2O,于是用CuSO4溶液与NaOH溶液反应制取氢氧化铜,然后对氢氧化铜进行加热,并用如图所示的装置用一氧化碳还原氢氧化铜完全分解得到的氧化铜。
(1)制取氢氧化铜的化学方程式为_________________________________;
(2)B处可观察到的现象是___________________________,C处酒精灯的作用是________________,小明在做一氧化碳还原氧化铜实验时,硬质玻璃管内发生了爆炸,你认为可能的原因有_________、___________________________________;
(3)实验结束后,该同学对A处残留的红色固体的成分进行如下探究:
【查阅资料】①由于给氧化铜加热温度不够或通入一氧化碳不足,可能生成中间产物氧化亚铜(化学式Cu2O)。
②氧化亚铜是一种红色固体,难溶于水,可与稀硫酸发生如下反应:Cu2O+H2SO4==CuSO4+Cu+H2O
【提出猜想】红色固体是:I____________________;ⅡCu2O;ⅢCu和Cu2O的混合物
【进行实验】
操作 | 现象 | 结论 |
①取一定量A处残留固体于试管中,加入足量的稀硫酸,并充分振荡,静置 | ______________________________ | 猜想Ⅲ成立 |
②过滤、洗涤、干燥 | 得到红色固体 |
(4)经测定1.6gA处残留固体与9.8g溶质质量分数为10%的稀盐酸恰好完全反应.试计算该残留固体中铜元素的质量分数___________________。
【答案】 CuSO4+2NaOH==Na2SO4+Cu(OH)2↓ 石灰水变浑浊 处理尾气 CO不纯 先加热后通CO Cu 固体部分溶解,溶液变为蓝色 解设原固体中Cu2O的质量为X 9.8g×10%=0.98g
Cu2O+H2SO4==CuSO4+Cu+H2O
144 98
X 0.98g
144:98=X:0.98g X=1.44g (1分)
1.44g×128/144=1.28g (1分) 1.28g+(1.6g—1.44g) =1.44g 1.44g ÷1.6g ×100%= 90%
答:略
【解析】(1)氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,化学方程式为CuSO4+2NaOH==Na2SO4+Cu(OH)2↓ ;(2)一氧化碳和氧化铜反应生成二氧化碳和铜;二氧化碳和氢氧化钙反应生成碳酸钙和水,B处可观察到的现象是澄清石灰水变浑浊;C处酒精灯的作用是点燃尾气中的一氧化碳,防止污染空气;点燃可燃性气体和氧气或空气的混合物时,有可能发生爆炸;做一氧化碳还原氧化铜实验时,硬质玻璃管内发生了爆炸,可能的原因有CO不纯 、先加热后通CO ,导致加热了一氧化碳和空气的混合物。(3)由题中信息可知,反应物氧化亚铜和铜都是红色固体,当刚好完全反应时固体为生成物铜;由于Cu2O+H2SO4==CuSO4+Cu+H2O,但是铜不与酸反应,所以会观察到溶液变蓝,固体部分溶解。解设原固体中Cu2O的质量为X 9.8g×10%=0.98g
Cu2O+H2SO4==CuSO4+Cu+H2O
144 98
X 0.98g
144:98=X:0.98g X=1.44g
1.44g×128/144=1.28g 1.28g+(1.6g—1.44g) =1.44g 1.44g ÷1.6g ×100%= 90%
答:略

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案【题目】在一定温度下,将![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 的硝酸钾固体分别加入到
的硝酸钾固体分别加入到![]() 水中,其五次实验数据记录如下表:(
水中,其五次实验数据记录如下表:(![]() 的溶解能力随温度升高而增大)
的溶解能力随温度升高而增大)
实验次数 | 1 | 2 | 3 | 4 | 5 |
加入 | 30 | 40 | 50 | 60 | 70 |
所得 | 80 | 90 | 100 | 105 | 105 |
根据表中数据分析回答下列问题:
(1)第_________次起得到的![]() 溶液为饱和溶液;
溶液为饱和溶液;
(2)在该温度下, ![]() 水中溶解___________
水中溶解___________ ![]() 刚好达到饱和,所得溶液的溶质质量分数是___;
刚好达到饱和,所得溶液的溶质质量分数是___;
(3)要使接近饱和的![]() 溶液,在不改变溶液质量的前提下变为饱和溶液,可以采用的方法是_;
溶液,在不改变溶液质量的前提下变为饱和溶液,可以采用的方法是_;
(4)如图所示,小烧杯中盛放的是硝酸钾的饱和溶液,若将少量的下列物质分别放入大烧杯中的水中,不断搅拌,则小烧杯中一定有硝酸钾晶体析出的是_________(填字母)。

A.硝酸铵 B.氢氧化钠 C.冰 D.浓硫酸
(5)通过___________操作可将上述(4)中析出的硝酸钾晶体与硝酸钾溶液分离。