题目内容
【题目】如图1所示的4个实验,得出的结论不正确的是
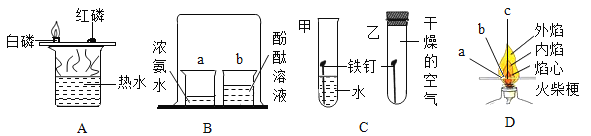
A. 白磷燃烧,红磷不燃烧,说明白磷的着火点比红磷的着火点低
B. 烧杯b中的酚酞试液变红色,说明分子不断运动
C. 甲试管的铁钉生锈,乙试管的铁钉不生锈,说明只需与水接触铁钉就会生锈
D. 火柴梗的a点最先炭化,说明火焰的外焰温度最高
【答案】C
【解析】A. 白磷和红磷的温度相同,白磷燃烧,红磷不燃烧,说明白磷的着火点比红磷的着火点低;B. 烧杯b中的酚酞试液变红色,说明分子不断运动,a中的氨气分子通过运动进入b中形成氨水,溶液显碱性,使酚酞试液变红;C. 甲试管的铁钉生锈,乙试管的铁钉不生锈,只能说明不与水接触铁钉就不会生锈;D. 火柴梗的a点最先炭化,说明火焰的外焰温度最高;

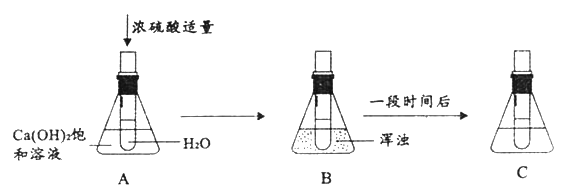
【题目】小明在课外阅读中得知:氢氧化铜受热会分解生成氧化铜,反应的化学方程式为Cu(OH)2![]() CuO +H2O,于是用CuSO4溶液与NaOH溶液反应制取氢氧化铜,然后对氢氧化铜进行加热,并用如图所示的装置用一氧化碳还原氢氧化铜完全分解得到的氧化铜。
CuO +H2O,于是用CuSO4溶液与NaOH溶液反应制取氢氧化铜,然后对氢氧化铜进行加热,并用如图所示的装置用一氧化碳还原氢氧化铜完全分解得到的氧化铜。
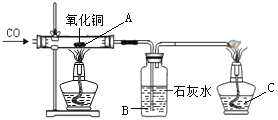
(1)制取氢氧化铜的化学方程式为_________________________________;
(2)B处可观察到的现象是___________________________,C处酒精灯的作用是________________,小明在做一氧化碳还原氧化铜实验时,硬质玻璃管内发生了爆炸,你认为可能的原因有_________、___________________________________;
(3)实验结束后,该同学对A处残留的红色固体的成分进行如下探究:
【查阅资料】①由于给氧化铜加热温度不够或通入一氧化碳不足,可能生成中间产物氧化亚铜(化学式Cu2O)。
②氧化亚铜是一种红色固体,难溶于水,可与稀硫酸发生如下反应:Cu2O+H2SO4==CuSO4+Cu+H2O
【提出猜想】红色固体是:I____________________;ⅡCu2O;ⅢCu和Cu2O的混合物
【进行实验】
操作 | 现象 | 结论 |
①取一定量A处残留固体于试管中,加入足量的稀硫酸,并充分振荡,静置 | ______________________________ | 猜想Ⅲ成立 |
②过滤、洗涤、干燥 | 得到红色固体 |
(4)经测定1.6gA处残留固体与9.8g溶质质量分数为10%的稀盐酸恰好完全反应.试计算该残留固体中铜元素的质量分数___________________。