题目内容
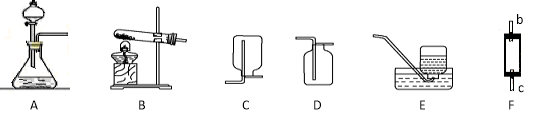
【题目】如图是实验室制取并验证CO2性质的有关装置。
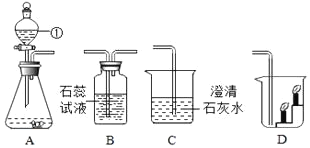
(1)仪器①的名称是_____。
(2)组装好装置A后,首先必须_____。
(3)若A与B连接,并发生反应,则B中紫色石蕊试液变_____色。
(4)若A与C连接,C中发生反应的化学方程式为_____。
(5)若A与D连接,可证明CO2具有的性质是_____。
(6)实验室用10g含碳酸钙80%的大理石最多可制得CO2多少_____g?(大理石中的杂质不参加反应)
【答案】分液漏斗 检查装置的气密性 红 Ca(OH)2+CO2═H2O+CaCO3↓ 密度比空气大,不能燃烧也不能支持燃烧 3.52g
【解析】
(1)分液漏斗可以控制反应的速率;
(2)组装好装置A后,必须首先检查装置的气密性;
(3)碳酸能使紫色石蕊试液变红色;
(4)若A与C连接,C中发生反应的化学方程式为Ca(OH)2+CO2═H2O+CaCO3↓。
(5)若A与D连接,可证明CO2具有的性质是密度比空气大,不能燃烧也不能支持燃烧。
(6)解:设可制得CO2的质量为X. 样品中含碳酸钙的质量为:10g×80%=8g。
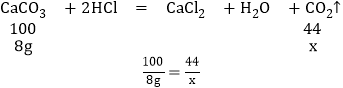
解得X=3.52g
答:实验室用10g含碳酸钙80%的大理石最多可制得CO2的质量为3.52g。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】某公司生产的新型融雪剂的成分是无水CaCl2和少量的氯化钠,为测定融雪剂中氯化钙的含量,化学兴趣小组的同学称取该样品12g,加水充分溶解,得到溶液50g,然后取一定质量分数的碳酸钠溶液100g平均分五次加入,充分振荡,实验数据见表。请你分析数据并进行有关计算。
次 数 | 1 | 2 | 3 | 4 | 5 |
加入碳酸钠溶液的质量/g | 20 | 20 | 20 | 20 | 20 |
生成沉淀的质量/g | 2.5 | x | 7.5 | 10 | 10 |
(1)上表中x的数值为_____。第_____次加入的碳酸钠与氯化钙恰好完全反应。
(2)样品中氯化钙的质量分数是多少_____?
(3)恰好完全反应时过滤,所得不饱和溶液的溶质质量分数是多少_____?
【题目】如图是元素周期表的一部分,试回答下列问题
第一周期 | 1H | 2He | ||||||
第二周期 | 3Li | 4Be | 5B | 6C | ① | ② | 9F | 10Ne |
第三周期 | 11Na | 12Mg | ③ | 14Si | 15P | 16S | 17Cl | 18Ar |
(1)①所示元素是_____(填“金属元素”或“非金属元素”)
(2)②所示元素与③所示元素形成的化合物的化学式是_____。
(3)用化学符号表示:2个镁离子_____,二氧化硅中硅的化合价_____。