题目内容
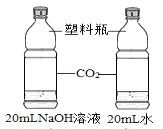
【题目】学校探究小组为了测定市面销售的某品牌纯碱(杂质为 NaCl)中碳酸钠的质量分数,在一烧杯中加入 11g 样品,加足量水溶解,制成溶液。向其中逐渐滴加溶质质量分数为 10% 的 CaCl2 溶液,生成沉淀的总质量与所滴入 CaCl2 溶液的质量关系曲线如图所示。请根据题意回答问题:
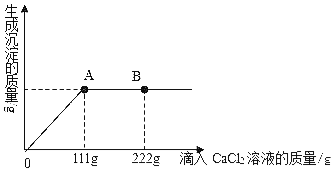
(1)当滴加了 111gCaCl2 溶液时,生成沉淀的总质量为_____g。
(2)当滴加 CaCl2 溶液至图中 B 点时,烧杯中溶液里的溶质是_____(写化学式)。
(3)当滴加了111gCaCl2 溶液时(即 A 点时),烧杯中为不饱和溶液,试通过计算求反应后所得溶液中溶质质量分数_____。
【答案】10 氯化钠、氯化钙 10.8%
【解析】
(1)设生成碳酸钙沉淀的质量为x。
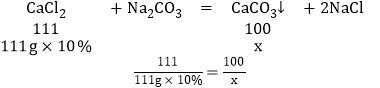
解之得x=10g。
(2)碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,当二者恰好完全反应时,反应后溶液为氯化钠溶液;继续加入氯化钙溶液,过量的氯化钙溶液不再发生反应,形成混合溶液,溶质为氯化钠、氯化钙;
(3)解:111g10%的CaCl2溶液中含CaCl2的质量是:111g×10%=11.1g。
设参加反应的碳酸钠的质量为x,反应生成的氯化钠的质量为y。
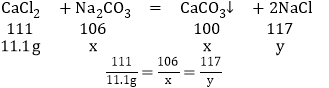
解之得 x=10.6g
y=11.7g
烧杯里不饱和溶液中溶质的质量为:11.7g+(11g﹣10.6g)=12.1g
故当滴加了111gCaCl2 溶液时(即 A 点时),烧杯中为不饱和溶液,反应后所得溶液中溶质质量分数为:![]() 10.8%。
10.8%。
故答案为:
(1)10g;(2)氯化钠、氯化钙;(3)10.8%。

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目