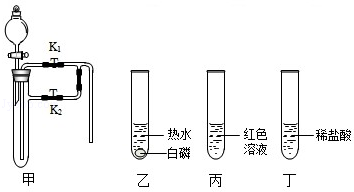
题目内容
实验室里,试剂瓶的标签常因脱落或被腐蚀而丢失,现有失去标签的6瓶溶液,可能是NaCl、Na2CO3、NaOH、CaCl2、Ca(OH)2、HCl、CuSO4七种物质中的六种,教师将它们编号为A、B、C、D、E、F,让同学们鉴别这六种物质,请你参与小明的下列鉴别过程.
[查阅资料]:CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl
(1)观察各种溶液的颜色,其中C瓶为 色,是硫酸铜溶液.
(2)做两两混合实验,E与其他四种物质混合的实验现象记录如下:
| | A | B | D | F |
| E | 无现象 | 白色沉淀 | 无色气泡 | 白色沉淀 |
由此实验确定 E是 (写化学式),还能确定 .
(3)若只用酚酞溶液,进一步确定另外三种物质的成分,你的实验设计是(填下表):
| 实验操作 | 实验现象及实验结论 |
| | |
(4)六种物质都鉴别出来以后,小明将NaOH溶液和Na2CO3溶液混合,再滴加稀盐酸,从开始滴加稀盐酸到过量的现象是 ;此时溶液中的溶质为 .
故答案为:(1)蓝;(2)Na2CO3;D是HCl;
(3)实验操作 实验现象及实验结论 取B、F各少量于试管中,分别滴加无色酚酞试液
另取A溶液少量于试管中,滴加无色酚酞试液 一支试管中无色酚酞试液变红,另一支不变色.
变红的原溶液为氢氧化钙溶液,不变的原溶液为氯化钙溶液.
若试液变为红色,则原液为氢氧化钠.否则为氯化纳.
(4)开始无明显现象,过一段时间出现气泡;NaCl、HCl
解析试题分析:(1)硫酸铜溶液为蓝色,而其他溶液都是无色的,所以可以确定蓝色溶液为硫酸铜溶液;(2)根据剩余物质的性质可以知道:碳酸钠可以和氯化钙生成白色沉淀,同时也可以和氢氧化钙溶液反应生成白色沉淀,也能够和盐酸反应生成二氧化碳气体,所以可以判断E为碳酸钠,D为盐酸;(3)根据(1)和(2)的解答可以知道剩余的三种物质为:CaCl2和Ca(OH)2或NaCl、NaOH中的一种,根据题中提供的试剂,可以利用这些溶液的酸碱性来进行区分.(4)氢氧化钠和碳酸钠的混合溶液中加入盐酸,盐酸先与氢氧化钠反应没有明显现象,当氢氧化钠反应完之后再加的盐酸与碳酸钠反应产生气泡,当盐酸过量时溶液中的溶质为生成的氯化钠和过量的HCl
考点:酸、碱、盐的鉴别.

 中考解读考点精练系列答案
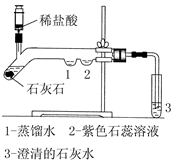
中考解读考点精练系列答案乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属。乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体。
【提出问题】白色固体是什么物质?
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二: ;猜想三:Ca(OH)2。
他的依据是 。
【交流反思】经过同学们交流讨论,认为猜想一不成立。否定猜想一的理由是: 。
【进行实验】
| | 实验操作 | 实验现象 | 结论 |
| 实验一 | 取样于试管中, 滴加稀盐酸 | | 猜想二:不成立 |
| 实验二 | | | 猜想三:成立 |
【实验结论】白色固体是Ca(OH)2。写出碳化钙与水反应制取乙炔的化学方程式 。
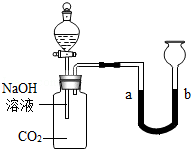
化学小组的同学用如图所示的装置探究二氧化碳的性质后,觉得探究很有意思,想继续探究.
[提出问题]反应后溶液中的溶质有什么?
[查阅资料](1)氢氧化钠与二氧化碳反应的化学方程式为 .
(2)在上述反应中,若二氧化碳过量,能发生如下反应:
Na2CO3+H2O+CO2=2NaHCO3
[猜想与假设]通过分析,小明做出如下猜想:
①含有NaOH和 Na2CO3;②含有Na2CO3和NaHCO3;
[实验探究]为确定反应后溶液的组成,同学进行了如下两项探究活动.
(1)对相关物质性质的研究.
| | NaHCO3溶液 | NaOH溶液, | Na2CO3溶液 |
| 加入稀盐酸 | 产生气泡 | 无明显变化 | 产生气泡 |
| 加入饱和石灰水 | 溶液变浑浊 | 溶液变浑浊 | 现象I |
| 加入CaCl2溶液 | 无明显变化 | 溶液变浑浊 | 溶液变浑浊 |
| 加热溶液至沸腾,将 气体通入澄清石灰水 | 澄清石灰水 变浑浊 | 澄清石灰水 无明显变化 | 澄清石灰水 无明显变化 |
上表中现象I对应的化学方程式为 .
(2)探究反应后溶液的成分.为确认反应后溶液的组成,小明设计了如下实验过程
| 实验步骤 | 操作 | 实验现象 | 实验结论 |
| ① | 取一定量反应后溶液放入试管中,滴加适量的CaCl2溶液. | 有沉淀产生 | |
| ② | 将步骤①所得的混合物过滤,洗涤,并将滤渣分成两部分. | | |
| ③ | 向其中一份步骤②所得固体中滴加稀盐酸. | 有气泡产生. | 原溶液中含有 . |
| ④ | 取另一份步骤②所得固体, . | . | 猜想1正确 |
[反思与评价]
(1)若想直接证明小明的另一个猜想不正确,在上述方案的基础上,应加做的实验是
.
(2)小伟提出,小明的猜想不完全,反应后溶液的组成还可能是 (有几种写几种).
暖宝宝是一种防寒用品,如图所示。暖宝宝中的主要成分有哪些?发热的原因是什么?
(1)小明探究:暖宝宝中的主要成分是什么?
剪开内包装袋,倒出其中的粉末,发现呈黑色。
【提出猜想】该黑色粉末可能含有炭粉、铁粉、二氧化锰、氧化铜、四氧化三铁中的一种或几种。
【初步验证】将磁铁靠近黑色粉末,部分被吸引。
【查阅资料】四氧化三铁具有磁性,能被磁铁吸引;炭粉、二氧化锰不与稀硫酸反应;氧化铜与稀硫酸反应后溶液呈蓝色。
【得出结论】该黑色粉末可能含有(写物质的名称) 。
【进行实验】
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取黑色粉末加足量稀硫酸 | 固体部分溶解,有气泡产生,溶液无蓝色 |
| ② | 取实验①的残渣灼烧,将内壁涂 有澄清石灰水的小烧杯罩在上方 | 澄清石灰水变浑浊 |
由实验①可知,该黑色粉末中肯定含_____________,肯定不含______________。
由实验②可知,该黑色粉末肯定含 。
(2)小明思考:暖宝宝为什么会发热?
【查阅资料】暖宝宝中的铁粉在空气中发生了缓慢氧化,进而放出热量。由此可见,
人们可以利用化学反应放出的能量,请再举一例:___________________。
(3)人们利用化学反应还可以_______________________。
(4)课外小组的同学研究的课题是测定贝壳中碳酸钙的质量分数,他们取25g贝壳粉碎后放入烧杯中,向杯中倒入稀盐酸,当倒入100g稀盐酸后发现不再产生气泡,并测得烧杯内固体和液体总质量为120.6g (杂质不反应)。求贝壳中碳酸钙的质量分数。
“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
【实验探究一】氧化铁能否作过氧化氢溶液分解的催化剂?如果能,催化效果如何?
| 实验步骤 | 实验现象 |
| I.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 |
| III.将实验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 | |
| IV分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 | |
(1)由实验Ⅰ你可以得出的结论是 ;
(2)实验II、III证明:氧化铁的 和 在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)写出氧化铁催化过氧化氢分解的符号表达式 ;
【实验评价】
(4)若实验IV观察到D试管中产生气泡的速率更快,由此你可以得到的结论是 。
【实验探究二】影响化学反应的速率除了催化剂以外,还有其它因素吗?以下是另一实验小组探究影响反应速率部分因素的相关实验数据。
| 实验序号 | H2O2溶 液浓度% | H2O2溶液体积/mL | 温度℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需 的时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | 0 | 2 | 49.21 |
| ④ | 30 | 5 | 55 | 0 | 2 | 10.76 |
(5)通过实验①和②对比可知,化学反应速率还与 有关;从实验 和 对比可知,化学反应速率与温度的关系是: ;
(6)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的概率有关。试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是: 。