题目内容
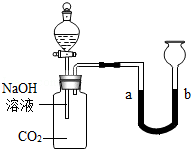
化学小组的同学用如图所示的装置探究二氧化碳的性质后,觉得探究很有意思,想继续探究.
[提出问题]反应后溶液中的溶质有什么?
[查阅资料](1)氢氧化钠与二氧化碳反应的化学方程式为 .
(2)在上述反应中,若二氧化碳过量,能发生如下反应:
Na2CO3+H2O+CO2=2NaHCO3
[猜想与假设]通过分析,小明做出如下猜想:
①含有NaOH和 Na2CO3;②含有Na2CO3和NaHCO3;
[实验探究]为确定反应后溶液的组成,同学进行了如下两项探究活动.
(1)对相关物质性质的研究.
| | NaHCO3溶液 | NaOH溶液, | Na2CO3溶液 |
| 加入稀盐酸 | 产生气泡 | 无明显变化 | 产生气泡 |
| 加入饱和石灰水 | 溶液变浑浊 | 溶液变浑浊 | 现象I |
| 加入CaCl2溶液 | 无明显变化 | 溶液变浑浊 | 溶液变浑浊 |
| 加热溶液至沸腾,将 气体通入澄清石灰水 | 澄清石灰水 变浑浊 | 澄清石灰水 无明显变化 | 澄清石灰水 无明显变化 |
上表中现象I对应的化学方程式为 .
(2)探究反应后溶液的成分.为确认反应后溶液的组成,小明设计了如下实验过程
| 实验步骤 | 操作 | 实验现象 | 实验结论 |
| ① | 取一定量反应后溶液放入试管中,滴加适量的CaCl2溶液. | 有沉淀产生 | |
| ② | 将步骤①所得的混合物过滤,洗涤,并将滤渣分成两部分. | | |
| ③ | 向其中一份步骤②所得固体中滴加稀盐酸. | 有气泡产生. | 原溶液中含有 . |
| ④ | 取另一份步骤②所得固体, . | . | 猜想1正确 |
[反思与评价]
(1)若想直接证明小明的另一个猜想不正确,在上述方案的基础上,应加做的实验是
.
(2)小伟提出,小明的猜想不完全,反应后溶液的组成还可能是 (有几种写几种).
[查阅资料]2NaOH+CO2=Na2CO3+H2O [实验探究](1)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
(2)
③Na2CO3.
④溶于水,然后向上层清液中滴加无色酚酞溶液.无色酚酞溶液变为红色.原溶液中有NaOH.
[反思与评价](1)取实验步骤②所得的滤液适量于试管中,加热,将产生的气体通入澄清石灰水,石灰水不变浑浊,证明小明的猜想②不正确.
(2)A:只有碳酸钠 B:只有碳酸氢钠
解析试题分析: [查阅资料](1)氢氧化钠与二氧化碳反应生成碳酸钠和水,反应的化学方程式为 2NaOH+CO2=Na2CO3+H2O[实验探究]碳酸钠与氢氧化钙能反应生成碳酸钙和氢氧化钠,化学方程式Ca(OH)2+Na2CO3=CaCO3↓+2NaOH(2)取一定量反应后溶液放入试管中,滴加适量的CaCl2溶液.有沉淀产生,说明含有氢氧化钠或碳酸钠,将步骤①所得的混合物过滤,洗涤,并将滤渣分成两部分,向其中一份步骤②所得固体中滴加稀盐酸,有气泡产生,说明沉淀中含有碳酸钙,则溶液中一定含有碳酸钠,若猜想①正确,取另一份步骤②所得固体,溶液于水,然后向上层清液中滴加无色酚酞溶液,无色酚酞溶液变为红色,说明沉淀中含有氢氧化钙,则原溶液中含有氢氧化钠.[反思与评价](1)小明的另一个猜想含有Na2CO3和NaHCO3不正确,根据两种物质的性质可取实验步骤②所得的滤液适量于试管中,加热,将产生的气体通入澄清石灰水,石灰水不变浑浊,证明小明的猜想②不正确.(2)根据化学反应2NaOH+CO2=Na2CO3+H2O和Na2CO3+H2O+CO2=2NaHCO3可知,反应后的溶液中的溶质还可能只有碳酸钠或只有碳酸氢钠.
考点:实验探究物质的组成成分以及含量;碱的化学性质.

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案某研究小组欲检验草酸晶体样品分解产物,并测定样品中草酸晶体的质量分数(假设杂质不参与反应)。已知:浓硫酸可作为干燥剂;草酸晶体(H2C2O4·2H2O )的性质见下表:
| 熔点 | 沸点 | 热稳定性 | 其他 |
| 101℃~102℃ | 150℃~160℃升华 | 100.1℃分解出水,175℃分解成CO2、CO、H2O | 与 Ca(OH)2反应产生白色沉淀(CaC2O4) |

(2)图 2 是验证热分解产物中含 CO 、 CO2的装置。
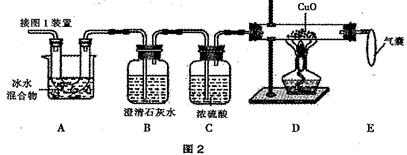
① 装置 A 的作用是_____________________,气囊的作用是_____________________。
② 证明存在 CO2的现象是______________,证明存在 CO 的现象是______________。
(3)为测定样品中草酸晶体的质量分数,设计如下方案:称取一定量样品,用上述装置进行实验,称量装置D反应前后的质量差。由此计算出的实验结果比实际值偏低,排除仪器和操作因素,其可能原因:_________________________________________________。
碳酸钙在高温下煅烧一段时间后,得到白色固体(CaCO3 CaO+CO2↑),为了确定白色固体的成分,对其可能的组成进行探究,请你完成下表.
CaO+CO2↑),为了确定白色固体的成分,对其可能的组成进行探究,请你完成下表.
| 假设(猜想) | 验证方法及操作 | 可能看到的现象 | 结 论 |
| | | | |
葡萄糖是生命体所需能量的主要来源.
提出问题:葡萄糖燃烧的产物是CO2和H2O,由此能否推断葡萄糖是由碳元素和氢元素组成的有机物?
实验设计:为了确定葡萄糖的元素组成,某小组设计了如下实验(其中浓硫酸、无水CaCl2均为常用干燥剂,部分固定装置省略,假设每个装置中均吸收完全或反应完全。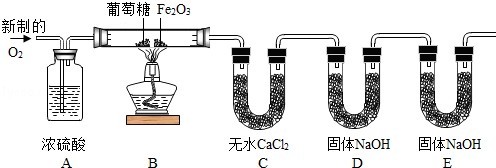
| 小贴士 含碳元素的化合物完全燃烧生成CO2 、H2O,不完全燃烧时生成CO、CO2 和H2O |
(2)装置B处Fe2O3可能发生的化学反应的方程式为 .
方案评价:
用充有空气的储气球代替制备氧气的装置,是否更有利于实验的进行,为什么? .(填“是”或“否”及理由)
数据处理:下表是同学们填写的实验报告,请你帮助完成.
| 实验事实 | 数据分析及结论 |
| 1.8g葡萄糖完全燃烧,得到2.64g CO2和1.08g H2O | 结论:葡萄糖含有 元素 数据分析的依据是 . |
讨论交流:上述实验装置D、E中盛放的都是NaOH固体,试分析两次使用NaOH固体的作用分别是什么? .
膨松剂是一种食品添加剂.它在面包制作过程中发生反应产生气体,使面包变得松软.膨松剂反应产生气体的量作为检验膨松剂品质的一项重要指标.已知某膨松剂含碳酸氢钠、碳酸氢铵(NH4HCO3)中的一种或两种,化学兴趣小组对该膨松剂进行如下探究: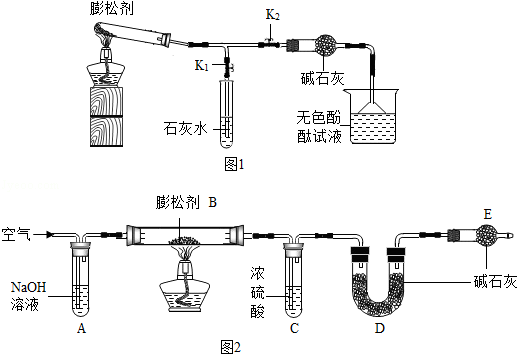
【查阅资料】
①2NaHCO3 Na2CO3+H2O+CO2↑; NH4HCO3
Na2CO3+H2O+CO2↑; NH4HCO3 NH3↑+H2O+CO2↑.
NH3↑+H2O+CO2↑.
②浓硫酸常用于吸收水蒸气和氨气.
③碱石灰是固体氢氧化钠和氧化钙的混合物,不与氨气反应.
实验I:探究膨松剂的成分
按如图1所示连接好装置(夹持仪器略去,下同).
(1)实验记录
| 实验操作 | 主要实验现象 | 实验结论及解释 | |
| ① | 检查装置的气密性. 向装置中加入药品. 关闭K1,打开K2 | | 装置的气密性良好. |
| ② | 点燃酒精灯. 打开K1,关闭K2. | 试管中白色固体减少, | 有二氧化碳生成,A中反应的化学方程式为 . |
| ③ | 打开K2,关闭K1. | 无色酚酞试液变红 | 有氨气生成. |
| ④ | 继续充分加热. | 试管中仍有固体 | |
(2)得出结论:该膨松剂的成分为 .
实验II:探究膨松剂受热产生气体的量
(1)测定二氧化碳的质量:如图2所示装置(气密性良好,各装置中的试剂为足量).
将8g膨松剂装入装置B中,通过测定实验前后装置 (填字母序号)的质量,其质量差即为样品产生的二氧化碳气体的质量.加热前,先对已连接好的装置A、B和C通一段时间的空气,再连接上装置D、E;加热过程中,装置C的作用是 ;停止加热后,应继续通入空气一段时间,以保证产生的气体被装置充分吸收.
(2)测定氨气的质量:调整图2装置的连接顺序为 .另取8g膨松剂装入装置B中,通过测定实验前后装置C的质量,其质量差即为样品产生的氨气的质量.
【解释与结论】同学们进一步对实验结果进行分析后,认为该膨松剂质量良好.
【反思与评价】实验II中,若没有装置E,造成测定结果可能会 (填“偏大”、“不变”或“偏小”).
实验室里,试剂瓶的标签常因脱落或被腐蚀而丢失,现有失去标签的6瓶溶液,可能是NaCl、Na2CO3、NaOH、CaCl2、Ca(OH)2、HCl、CuSO4七种物质中的六种,教师将它们编号为A、B、C、D、E、F,让同学们鉴别这六种物质,请你参与小明的下列鉴别过程.
[查阅资料]:CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl
(1)观察各种溶液的颜色,其中C瓶为 色,是硫酸铜溶液.
(2)做两两混合实验,E与其他四种物质混合的实验现象记录如下:
| | A | B | D | F |
| E | 无现象 | 白色沉淀 | 无色气泡 | 白色沉淀 |
由此实验确定 E是 (写化学式),还能确定 .
(3)若只用酚酞溶液,进一步确定另外三种物质的成分,你的实验设计是(填下表):
| 实验操作 | 实验现象及实验结论 |
| | |
(4)六种物质都鉴别出来以后,小明将NaOH溶液和Na2CO3溶液混合,再滴加稀盐酸,从开始滴加稀盐酸到过量的现象是 ;此时溶液中的溶质为 .
同学们在学习了木炭还原氧化铜的实验后,联想到单质碳的一些化学性质,对反应后的气体成分产生了疑问,某学习小组对该反应产物中的气体成分进行了探究。
〔猜 想〕
①气体产物全部是CO2 ②气体产物全部是CO ③气体产物
〔查阅资料〕 CO气体能使湿润的黄色氯化钯试纸变蓝色。
〔设计实验〕根据各自的猜想,他们共同设计了如下图的实验装置进行探究。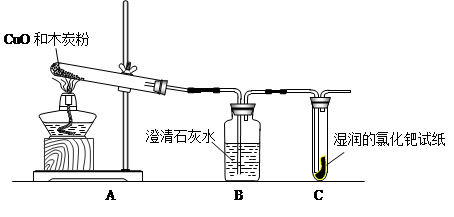
〔现象与分析〕
| 现象 | 结论 |
| 如果装置B , 装置C无现象 | 则猜想①成立 |
| 如果装置B无现象,装置C | 则猜想②成立 |
| 如果装置B ,装置C____________ | 则猜想③成立 |
〔结论〕实验现象证明猜想③成立,同学们的疑问是合理的。
〔反思〕
(1)同学们对CO产生的原因进行了分析:
①原因一:木炭和氧化铜在高温条件下直接发生反出产生CO;
②原因二:反应C+2CuO
 2Cu+CO2↑中的一种产物和反应物木炭又发生了化学反应,产生了CO;
2Cu+CO2↑中的一种产物和反应物木炭又发生了化学反应,产生了CO;请你从原因一、原因二中选择其一,用化学方程式表示存在此原因的化学反应原理______________________________________________。
(2)根据上述实验,请你归纳出单质碳在工业上的重要用途
铁暴露在空气中会生锈。不知你注意了没有,将苹果切开不久,果肉上就会产生一层咖啡色的物质,也好象是生了“锈”一样。某化学活动小组对此进行了探究。
【提出问题】切开的苹果“生锈”与什么因素有关?
【猜想与假设】
猜想①:可能是果肉中的物质与空气中的氮气作用而“生锈”;
猜想②:可能是果肉中的物质与空气中的氧气作用而“生锈”;
猜想③:可能是果肉中的物质与空气中的二氧化碳作用而“生锈”;
【收集证据】
(一)查阅有关资料:已知苹果“生锈”是果肉里的物质(酚和酶)与空气中的一种物质发生氧化反应,生成咖啡色的物质。且温度越高反应越快。
(二)实验探究:针对上面的猜想,化学活动小组依次设计了实验方案,将苹果肉分别放入 三种气体中,依次观察到下列实验现象。请你帮他们填写下表。
| | 氮气 | 氧气 | 二氧化碳 |
| 现象 | 不变色 | 变色 | |
| 结论 | 果肉变色与氮气无关 | | 果肉变色与二氧化碳无关 |
【反思与评价】
在三种猜想中,你认为猜想 (填代号)最不合理, 理由是 。
【应用】根据上述结论,要防止果汁变质,果品加工和保存果汁时可采取的措施是 。(写一点即可)
