题目内容
乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属。乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体。
【提出问题】白色固体是什么物质?
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二: ;猜想三:Ca(OH)2。
他的依据是 。
【交流反思】经过同学们交流讨论,认为猜想一不成立。否定猜想一的理由是: 。
【进行实验】
| | 实验操作 | 实验现象 | 结论 |
| 实验一 | 取样于试管中, 滴加稀盐酸 | | 猜想二:不成立 |
| 实验二 | | | 猜想三:成立 |
【实验结论】白色固体是Ca(OH)2。写出碳化钙与水反应制取乙炔的化学方程式 。
【做出猜想】碳酸钙(CaCO3) 根据质量守恒定律
【交流反思】氧化钙与水反应也生成氢氧化钙
【进行实验】实验一:没现象(或没气泡)
实验二:取少量白色固体(或取样)加水溶解,取上层清液,通入二氧化碳气体(或取样,滴加酚酞试液)有白色沉淀出现(或有浑浊产生)(或酚酞显红色)
【实验结论】CaC2+2H2O=Ca(OH)2+C2H2↑
解析试题分析:根据质量守恒定律化学反应前后的元素种类不变,碳酸钙(CaCO3)根据质量守恒定律;氧化钙与水反应也生成氢氧化钙;实验现象是没现象(或没气泡),因为碳酸钙和稀盐酸反应会产生二氧化碳气体;取少量白色固体(或取样)加水溶解,取上层清液,通入二氧化碳气体(或取样,滴加酚酞试液);有白色沉淀出现(或有浑浊产生)(或酚酞显红色)碳化钙与水反应制取乙炔的化学方程式CaC2+2H2O=Ca(OH)2+C2H2↑。
考点:质量守恒定律、化学方程式的书写、实验探究。

 名校课堂系列答案
名校课堂系列答案小芳同学从超市购买了一瓶维生素C泡腾片。下图是标签上的部分内容。
| 维生素C泡腾片 功能:补充人体维生素C,增强机体抵抗力 主要成分:维生素C 辅料成分:碳酸氢钠、氯化钠、酒石酸晶体、蔗糖、糖精钠、阿朴胡萝卜醛、橘味香精、橙味香精、维生素B 贮藏:低温、避光、防潮 |
小芳同学根据使用说明将维生素C泡腾片放入一杯水中,发现维生素C泡腾片逐渐溶解,产生大量气泡,片刻后变为一杯鲜甜的橙味饮品。小芳同学感到很好奇,产生的气泡是什么呢?
请你参与小芳同学的探究:
【提出问题】维生素C泡腾片放入水中,产生的气泡是什么呢?
【我的猜想】气体成分是________,理由是_________________________。
【实验方案】
| 实验步骤 | 实验现象 | 实验结论 |
| 将一片维生素C泡腾片放入水中,将产生的气体通入__ __________________ | | |
根据维生素C泡腾片储存条件,请说明保存时要低温和防潮的原因是:
①______________________________________________________;
②______________________________________________________。
某研究小组欲检验草酸晶体样品分解产物,并测定样品中草酸晶体的质量分数(假设杂质不参与反应)。已知:浓硫酸可作为干燥剂;草酸晶体(H2C2O4·2H2O )的性质见下表:
| 熔点 | 沸点 | 热稳定性 | 其他 |
| 101℃~102℃ | 150℃~160℃升华 | 100.1℃分解出水,175℃分解成CO2、CO、H2O | 与 Ca(OH)2反应产生白色沉淀(CaC2O4) |

(2)图 2 是验证热分解产物中含 CO 、 CO2的装置。
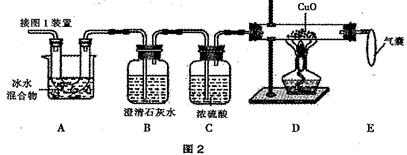
① 装置 A 的作用是_____________________,气囊的作用是_____________________。
② 证明存在 CO2的现象是______________,证明存在 CO 的现象是______________。
(3)为测定样品中草酸晶体的质量分数,设计如下方案:称取一定量样品,用上述装置进行实验,称量装置D反应前后的质量差。由此计算出的实验结果比实际值偏低,排除仪器和操作因素,其可能原因:_________________________________________________。
通常情况下,人体呼出气体中部分气体的含量和空气中部分气体的含量有所不同。请你根据所学的知识,完成下列实验报告。
| 操作步骤 | 现象 | 结论 |
| 取呼出气体和等体积的空气各一瓶,将燃着的小木条分别插入集气瓶中,盖上玻璃片 | | 人体呼出气体中氧气的含量小于空气中氧气的含量 |
| 取呼出气体和等体积的空气各一瓶,向其中各滴入相同滴数的澄清石灰水 | 呼出气体瓶中澄清石灰水变浑浊,空气瓶中无明显现象 | |
| | 被哈气的干燥玻璃片上有水珠,未被哈气的干燥玻璃片上没有明显现象 | 人体呼出气体中水蒸气的含量高于空气中水蒸气的含量 |
某兴趣小组的同学在老师的指导下,对一瓶没有塞橡皮塞的氢氧化钙溶液进行探究,请你一起参与.
【提出问题】该氢氧化钙溶液是否全部变质?
【猜想与假设】猜想①:氢氧化钙溶液可能全部变质,变成碳酸钙.
猜想②:氢氧化钙溶液可能部分变质,其成分是 .
【实验探究】
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取样于试管中,滴加稀盐酸 | 有 生成 | 原溶液里一定有碳酸钙 |
| (2)另取样于试管中,滴加酚酞试液 | 溶液成红色 | 原溶液一定有 |
【实验结论】综合上述实验(1)、(2),你得出的结论是猜想 成立.
【反思拓展】(1)氢氧化钙露置于空气中容易变质,原因是 (用化学方程式表示).
(2)在分析化学反应的物质成分时,除了考虑生成物外,还需考虑的是 .
某同学欲探究市售 “双钙防蛀”牙膏、“皓清”牙膏和牙粉的主要成分。
【查阅资料】
(1)牙膏和牙粉均是由摩擦剂、活性剂、香料等成分构成。
(2)常用的摩擦剂有极细颗粒的碳酸钙(CaCO3) 和水合硅酸(SiO2·nH2O)等
(3)牙膏和牙粉中除了碳酸钙以外,其它物质均不与稀盐酸反应产生气体。
【实验一】探究“两种牙膏和牙粉中是否都含有碳酸钙?
| 步骤 | 实验操作 | 实验现象 |
| ① |  如图所示,取三只试管分别加入适量待测样品,再分别加入适量R 溶液。R 溶液是 。 | A试管中无明显变化, B和C试管中有无色气体生成。 |
| ② | 将B和C试管中生成的无色气体通入澄清石灰水。 | 现象Ⅱ: 。 |
实验结论: 。
【实验二】比较样品中碳酸钙的含量
| 步骤 | 实验操作 | 实验现象 |
| ① | 组装两套如图装置进行实验。分别取 (操作Ⅰ),放于锥形瓶中。并在分液漏斗中分别加入等质量的R 溶液。  | |
| ② | 打开分液漏斗注入一定量R 溶液,然后关闭活塞。 | 有气泡产生。 |
| ③ | 待②反应结束后,再打开分液漏斗,注入一定量R 溶液,然后关闭活塞。 | 无明显现象 |
| ④ | 称量反应后装置及药品的总质量并加以比较 | 加入“双钙防蛀”牙膏的装置及药品的总质量大于加入牙粉的装置及药品的总质量 |
实验结论:_____________________________________________________
步骤③的作用是: 。
【反思】
(1)若不改动原有装置和基本步骤,要测定牙粉中碳酸钙的质量分数,还应测定的数据有:_______________________________________________________________
(2)小明认为该实验前不需要测定装置的气密性,请你说明其原因 。
实验室里,试剂瓶的标签常因脱落或被腐蚀而丢失,现有失去标签的6瓶溶液,可能是NaCl、Na2CO3、NaOH、CaCl2、Ca(OH)2、HCl、CuSO4七种物质中的六种,教师将它们编号为A、B、C、D、E、F,让同学们鉴别这六种物质,请你参与小明的下列鉴别过程.
[查阅资料]:CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl
(1)观察各种溶液的颜色,其中C瓶为 色,是硫酸铜溶液.
(2)做两两混合实验,E与其他四种物质混合的实验现象记录如下:
| | A | B | D | F |
| E | 无现象 | 白色沉淀 | 无色气泡 | 白色沉淀 |
由此实验确定 E是 (写化学式),还能确定 .
(3)若只用酚酞溶液,进一步确定另外三种物质的成分,你的实验设计是(填下表):
| 实验操作 | 实验现象及实验结论 |
| | |
(4)六种物质都鉴别出来以后,小明将NaOH溶液和Na2CO3溶液混合,再滴加稀盐酸,从开始滴加稀盐酸到过量的现象是 ;此时溶液中的溶质为 .

