题目内容
【题目】人体中的钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙晶体[Ca10(PO4)6(OH)2]形式存在,其相对分子质量为1004。牛奶含钙丰富又易吸收,且牛奶中钙和磷比例合适,是健骨的理想食品。下图是某乳业公司纯牛奶包装标签的部分文字。请仔细阅读后回答下列问题:

(1)包装标签上脂肪≥3.3g,是指100mL牛奶中含脂肪的质量至少3.3g。那么一盒牛奶含钙至少____g(保留到0.01g)
(2)求羟基磷酸钙中钙元素的质量分数___________(保留为0.1%)。
(3)若人体每天至少需要0.6g钙,且这些钙有90%来自牛奶,则一个人每天至少要喝__盒牛奶?
【答案】(1) 0.28 g ;(1分)
(2)解:(计算过程略)39.8%(1分);(格式1分)
(3)解:![]()
【解析】
试题
解:1、设:一盒牛奶中含钙的质量为X。
100:0.11=250:X
X=0.28g
2、羟基磷酸钙中钙元素的质量分数=![]() =39.8%;
=39.8%;
3、设:一个人每天至少要喝y盒牛奶。则:
y·0.28×90%=0.6
y=2
答:(略)

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】某学习小组在实验室中看到氢氧化钠(固体)试剂瓶标签上标注着“NaOH含量不少于96.0%”,提出对氢氧化钠固体中主要含有的杂质成分进行探究。
(提出问题)氢氧化钠固体中主要含有什么杂质?
(查阅资料)工业制取NaOH的反应原理是:2NaCl + 2H2O![]() 2NaOH + H2↑ + Cl2↑,然后蒸发溶剂获得氢氧化钠固体。
2NaOH + H2↑ + Cl2↑,然后蒸发溶剂获得氢氧化钠固体。
(提出猜想)氢氧化钠固体中主要杂质为Na2CO3和NaCl。
小组同学猜想含有NaCl的理由是:原料中的氯化钠没有完全转化为氢氧化钠;含有Na2CO3的理由是:___________。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
步骤①:取少量固体样品溶于水。 | 固体溶解,溶液温度明显上升 | 猜想正确 |
步骤②:待步骤①中溶液冷却后,向溶液中滴加过量_______。 | 开始无明显变化,后产生气泡 | |
步骤③:向步骤②所得溶液中滴加___________溶液。 | 产生白色沉淀 |
(实验反思)步骤②所得溶液中的溶质除NaCl外,还有______。
【题目】炼铁产生的废渣中含有大量CuS及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl2的流程图如图。
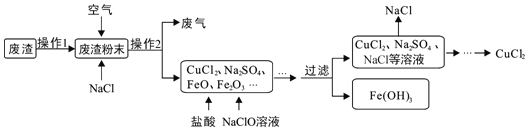
(1)废气中污染空气的气体主要是_____。
(2)在高温条件下,通入空气,CuS、NaCl等物质反应生成CuCl2和Na2SO4,该反应的化学方程式为_____。
(3)(查阅资料)不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH范围的方法,使某种金属氢氧化物沉淀,结合过滤等操作,进行物质分离。下表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH。
Fe(OH)3 | Cu(OH)2 | |
开始沉淀的pH | 1.9 | 4.2 |
沉淀完全的pH | 3.2 | 6.7 |
为了只让上述流程溶液中的Fe3+完全转化为Fe(OH)3沉淀而除去,你认为调节溶液的pH到_____(填数值范围)比较合适。
(4)流程图中能循环利用的物质是_____。
(5)本流程中,铁元素的化合价除+3价外还有_____。