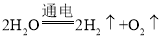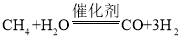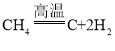题目内容
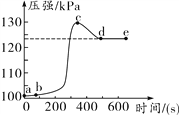
【题目】用铁粉和氧化铜的混合物8.32g进行如下实验:
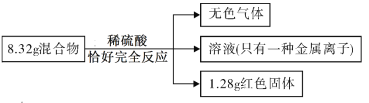
下列说法正确的是
A.8.32g混合物中含铁粉7.04g
B.无色气体质量为0.20g
C.溶液中硫酸亚铁的质量为15.20g
D.实验中参与反应的H2SO4的质量为9.80g
【答案】B
【解析】
由于溶液只含一种金属离子,所以只能是亚铁离子,混合物中的铜元素全部转化为单质铜。同时铁完全反应,铁参与两个反应,一个是和硫酸反应生成氢气,另一个是和生成的硫酸铜反应生成硫酸亚铁和铜。
设:与硫酸铜反应的铁的质量为x,与氧化铜反应的硫酸质量为y,生成的硫酸亚铁的质量为z,氧化铜的质量为w。
CuO+H2SO4=CuSO4+H2O Fe+CuSO4=FeSO4+Cu
可得关系式为:
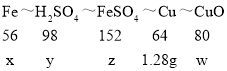
![]()
x=1.12g y=1.96g z=3.04g w=1.6g
则和硫酸反应的铁的质量为8.32g-1.12g-1.6g=5.6g;
设:铁与硫酸反应生成的硫酸亚铁的质量为a,生成的氢气的质量为b,消耗的硫酸的质量为c。
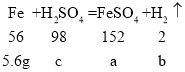
![]()
a=15.2g b=0.2g c=9.8g。
根据以上分析可知:
A、8.32g混合物中含铁粉=8.32g-1.6g=6.72g,故A错误;
B、无色气体质量为0.20g,故B正确;
C、溶液中硫酸亚铁的质量=15.20g+3.04g=18.24g,故C错误;
D、实验中参与反应的H2SO4的质量为1.96g+9.8g=11.76g,故D错误。故选B。

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目