题目内容
【题目】某中学化学兴趣小组通过实验测定某大理石中碳酸钙的质量分数,将盛有20.0g该样品的烧杯放在电子秤上,倒入100.0g稀盐酸(假设大理石样品中的杂质不与稀盐酸反应,也不溶于水),使该样品恰好完全反应,实验过程中的有关数据如下表所示:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
烧杯与所盛物质质量/g | 174.0 | 171.0 | 169.0 | 168.0 | 167.4 | 167.4 |
计算:
(1)生成二氧化碳的质量;
(2)该大理石中碳酸钙的质量分数;
(3)反应完成所得溶液中溶质的质量分数(精确到0.1%)
【答案】6.6g;75%;15.4%
【解析】
解:根据质量守恒定律,产生二氧化碳的质量为:174.0g-167.4g=6.6g
设该样品中CaCO3的质量为x,生成CaCl2的质量为y.
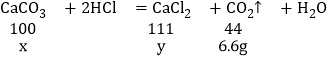
![]()
解得x=15.0g,y=16.65g
大理石中碳酸钙的质量分数为:![]() ×100%=75%
×100%=75%
反应后所得CaCl2溶液的质量为:100.0g+20.0g-20.0g×(1-75%)-6.6g=108.4g
反应后所得CaCl2溶液中溶质的质量分数为:![]() ×100%≈15.4%
×100%≈15.4%
答:(1)生成二氧化碳的质量为6.6g;
(2)该大理石中碳酸钙的质量分数为75%;
(3)反应完成所得溶液中溶质的质量分数为15.4%。

【题目】如图所示,将液体X加入到集气瓶中与固体Y作用,观察到气球逐渐变大,如表中液体X和固体Y的组合,符合题意的是( )
① | ② | ③ | ④ | ⑤ | |
X | 稀盐酸 | 水 | 水 | 双氧水 | 水 |
Y | 铁粉 | 氢氧化钠 | 氯化钠 | 二氧化锰 | 硝酸铵 |
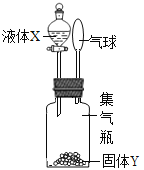
A. ①②⑤ B. ①③④ C. ①②④ D. ②③⑤
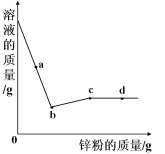
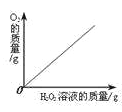
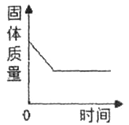
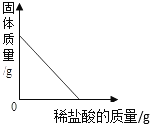
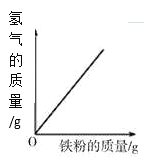
【题目】下列图象能正确反映对应变化关系的是( )
|
|
|
|
A.向一定量的二氧化锰中加入过氧化氢溶液 | B.将铁钉加入硫酸铜溶液中 | C.向一定量的大理石(杂质不参加反应)中加入足量的稀盐酸 | D.向一定质量的稀盐酸中加入足量铁粉 |
A. A B. B C. C D. D