题目内容
计算:
兴塘初中化学兴趣小组的同学在实验室用加热氯酸钾和二氧化锰固体混合物制取氧气时,反应前氯酸钾和二氧化锰混合物的质量为7克,加热到不再产生气体为止,剩余固体的质量为5.08克.则:
(1)反应能制得氧气质量为 克?
(2)原混合物中氯酸钾的质量分数为多少?
(1)1.92g (2)70%
解析试题分析:根据质量守恒定律,在化学反应前后,参加反应的各物质质量总和,等于反应后生成的各物质质量总和,所以反应生成氧气的质量为:7g-5.08g=1.92g
根据在化学反应中,各物质质量成比例,等于各物质的相对分子质量与系数乘积之比,所以可以根据生成氧气的质量,求需要氯酸钾的质量,即可求出原混合物中氯酸钾的质量分数。根据化学方程式计算的规范解题过程:设、写、标、列、解、答。
设生成1.92g氧气需要氯酸钾的质量为X,
2KClO3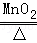 2KCl+3O2↑
2KCl+3O2↑
245 96
x 1.92g
根据:245/x=96/1.92g
解得:x=4.9g;
所以原混合物中氯酸钾的质量分数为:4.9g/7g×100%=70%;
考点:质量守恒定律、根据化学方程式进行计算

练习册系列答案
相关题目
某同学为了测定NaCl和MgCl2固体混合物中MgCl2的质量分数,进行如下实验:将80g固体混合物溶于水配成溶液,平均分成四份,分别加入相同质量分数的NaOH溶液,获得如下实验数据:
| 实验次数 | 一 | 二 | 三 | 四 |
| 固体混合物的质量(g) | 20 | 20 | 20 | 20 |
| 加入NaOH溶液的质量(g) | 20 | 40 | 60 | 80 |
| 生成沉淀的质量(g) | 2.9 | m | 8.7 | 8.7 |
(2)原固体混合物中MgCl2的质量分数是多少?(8分)(要求写出计算过程)
某钢铁厂需要测定一批生锈较严重的废钢材的锈蚀程度(假定该废钢成分为铁、氧化铁和杂质,杂质不溶于水不发生任何反应,而硫酸先与氧化铁反应),取该样品28g加入一洁净的烧杯中,再将足量的250克稀硫酸平均分为5次加入到烧杯中,获得实验数据如下:
| 稀硫酸质量(单位/g) | 50 | 50 | 50 | 50 | 50 |
| 烧杯内剩余物质总质量(单位/g) | 78 | 128 | 178 | 227.8 | 277.6 |
将烧杯内物质过滤得到滤液276.8g,试回答下列问题:(注:该题用初中知识解答)
(1)上述过程中生成气体的化学方程式为: ;
(2)共生成气体的质量是 ;
(3)根据已知条件列出求解参加反应的单质铁的质量(x)的比例式 ;
(4)所用稀硫酸的溶质质量分数是 ;
(5)该样品中被锈蚀的铁元素占原钢材(被锈蚀前的)的质量分数为 。(取整数)
 CaO+CO2↑)
CaO+CO2↑)