题目内容
某工厂需要280g生石灰(CaO)作干燥剂,需要碳酸钙的质量是多少?至少需要含碳酸钙80%的石灰石(杂质不参加反应)的质量是多少?(CaCO3 CaO+CO2↑)
CaO+CO2↑)
500g;625g.
解析试题分析:利用化学方程式结合氧化钙的质量可求出碳酸钙的质量;
根据纯物质的质量=含杂质物质的质量×物质的纯度,可求出含杂质的石灰石的质量;
解:设用去的碳酸钙的质量为x,
CaCO3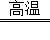 CaO+CO2↑
CaO+CO2↑
100 56
x 280g =
=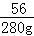
解得:x=500g
所以需要石灰石的质量为:500g÷80%=625g
答:需要碳酸钙的质量是500g;至少需要含碳酸钙80%的石灰石的质量是625g.
考点:利用化学方程式的计算

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
为测定混有少量氯化钠的碳酸钠固体中碳酸钠的质量分数,向盛有12g该混合物的烧杯中加入过量稀盐酸至碳酸钠完全反应。
反应过程用精密仪器测得烧杯和药品的质量与反应时间的数据记录如下:
| 反应时间 | t0 | t1 | t2 | t3 | t4 | t5 |
| 烧杯和药品质量/g | 210.0 | 206.7 | 205.9 | 205.6 | 205.6 | 205.6 |
(1)则完全反应后,生成二氧化碳的质量。
(2)请计算混合物中碳酸钠的质量分数(精确到0.1%)。
(3)假如称量准确,通过计算得到的碳酸钠的质量分数比实际数值偏小,其原因是 。
 CaO+CO2↑)
CaO+CO2↑)