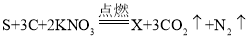题目内容
【题目】为探究化学反应前后,反应物与生成物之间的质量关系,三位同学分别做了以下三个实验:
实验一:称量镁条,点燃,待反应结束后再称量生成物质量。
实验二:将装有稀盐酸的小试管放入装有碳酸钙粉末的烧杯中称量,然后将盐酸倒出与碳酸钙粉末接触,过一会儿将试管放回烧杯中一起称量。
实验三:将装有氢氧化钠溶液的试管放入盛有硫酸铜溶液的烧杯中称量,然后将两种溶液混合,过一会儿将试管放回烧杯中一起称量。(化学方程式为:![]() )
)
实验数据见表:
实验一 | 实验二 | 实验三 | |
变化前 | 4.8g | 112.6g | 118.4g |
变化后 | 8.0g | 112.4g | 118.4g |
(1)写出实验二中发生反应的化学方程式___________________。
(2)这三个实验中,实验_________的数据能正确地反映了反应物与生成物之间的质量关系。实验一不能正确反映出反应物和生成物之间质量关系,原因是_________。
(4)同学们改进实验装置后,用镁条重做了实验,还发现产物中有少量黄色固体。
(提出问题)黄色固体是什么?
(查阅资料)
①氧化镁为白色固体。
②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,氨气有刺激性气味,该气体能使湿润的红色石落试纸变蓝。
(做出猜想)黄色固体是Mg3N2。
(实验探究)
进行实验:取少量黄色固体于试管中,加入适量水,把润的红色石蕊试纸放在试管口;
实验现象:生成有刺激性气味的气体,湿润的红色石蕊试纸由红色变______,同学们分析后,大家一致认为:黄色固体是Mg3N2。
(反思与交流)
空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是:_______________。
【答案】![]() 三 反应前没有称量参加反应的氧气质量或反应物有气体参加 蓝 氧气的化学性质比较活泼,而氮气的化学性质比较稳定
三 反应前没有称量参加反应的氧气质量或反应物有气体参加 蓝 氧气的化学性质比较活泼,而氮气的化学性质比较稳定
【解析】
(1)实验二中碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,发生反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)这三个实验中,实验三的数据能正确地反映了反应物与生成物之间的质量关系;实验一中,反应前没有称量参加反应的氧气质量或反应物有氧气参加了反应,导致反应后质量增大;
[实验探究] 取少量黄色固体于试管中,加入适量水,把润的红色石蕊试纸放在试管口,生成有刺激性气味的气体,试纸由红色变蓝色,说明氮化镁和水反应生成了氨气;
[反思与交流] 空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是:氧气的化学性质比较活泼,而氮气的化学性质比较稳定。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案