题目内容
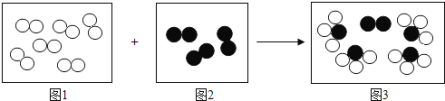
【题目】下图是某化学反应前后分子种类变化的微观示意图(其中“![]() ”表示氮原子,“
”表示氮原子,“![]() ”表示氧原子,“
”表示氧原子,“![]() ”表示氢原子)。
”表示氢原子)。
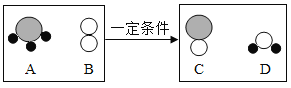
(1)该反应的化学方程式为________________。
(2)该反应中C与D的质量比为____________。
(3)所有化学反应发生的微观实质是______________。
【答案】4NH3+5O2 4NO+6H2O 10:9 分子破裂为原子,原子重新组成新的分子,化学变化前后原子的种类、数目不变,分子的种类一定改变
4NO+6H2O 10:9 分子破裂为原子,原子重新组成新的分子,化学变化前后原子的种类、数目不变,分子的种类一定改变
【解析】
(1)由图可知A的化学式为NH3;B的化学式为O2;C的化学式为NO;D的化学式为H2O,故该反应的化学方程式为4NH3+5O2 4NO+6H2O;
4NO+6H2O;
(2)反应中C和D的质量比为(4×30):(6×18)=10:9;
(3)所有化学反应发生的微观实质是分子破裂为原子,原子重新组成新的分子,化学变化前后原子的种类、数目不变,分子的种类一定改变。

【题目】为探究化学反应前后,反应物与生成物之间的质量关系,三位同学分别做了以下三个实验:
实验一:称量镁条,点燃,待反应结束后再称量生成物质量。
实验二:将装有稀盐酸的小试管放入装有碳酸钙粉末的烧杯中称量,然后将盐酸倒出与碳酸钙粉末接触,过一会儿将试管放回烧杯中一起称量。
实验三:将装有氢氧化钠溶液的试管放入盛有硫酸铜溶液的烧杯中称量,然后将两种溶液混合,过一会儿将试管放回烧杯中一起称量。(化学方程式为:![]() )
)
实验数据见表:
实验一 | 实验二 | 实验三 | |
变化前 | 4.8g | 112.6g | 118.4g |
变化后 | 8.0g | 112.4g | 118.4g |
(1)写出实验二中发生反应的化学方程式___________________。
(2)这三个实验中,实验_________的数据能正确地反映了反应物与生成物之间的质量关系。实验一不能正确反映出反应物和生成物之间质量关系,原因是_________。
(4)同学们改进实验装置后,用镁条重做了实验,还发现产物中有少量黄色固体。
(提出问题)黄色固体是什么?
(查阅资料)
①氧化镁为白色固体。
②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,氨气有刺激性气味,该气体能使湿润的红色石落试纸变蓝。
(做出猜想)黄色固体是Mg3N2。
(实验探究)
进行实验:取少量黄色固体于试管中,加入适量水,把润的红色石蕊试纸放在试管口;
实验现象:生成有刺激性气味的气体,湿润的红色石蕊试纸由红色变______,同学们分析后,大家一致认为:黄色固体是Mg3N2。
(反思与交流)
空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是:_______________。
【题目】同学们你还记得刚开始学习化学时做的下面这个实验吗?现在请你根据当时所做的实验完成下列有关实验报告:
实验操作 | 实验现象 | 实验结论 |
(1)用10mL量筒量取2mL氢氧化钠溶液,倒入试管中,然后用滴管向该试管中滴加硫酸铜溶液 | 观察到的现象_____ | 发生反应的化学方程式_____ |
(2)用试管夹夹住该试管(夹在距试管口约_____处),按照正确的加热方法加热。 | 观察到的现象_____ | 发生反应的化学方程式 |