题目内容
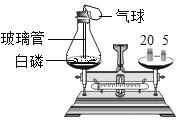
【题目】某化学兴趣小组对碳和碳的氧化物的有关性质进行探究。请你参与。二氧化碳与水的反应。取四朵用石蕊试液染成紫色的干燥小花,按图所示步骤进行实验。
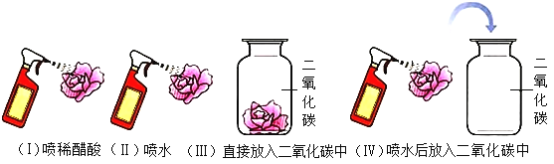
(1)二氧化碳与水反应的化学方程式为_____。
(2)通过步骤(Ⅱ)和步骤(Ⅲ)两个实验,可得出结论是_____。
(3)步骤(I)和(Ⅳ)的实验中,小花都变成了红色。由此,得出的结论是_____。
(4)为证明碳酸是否稳定,在步骤(Ⅳ)的基础上还应进行的操作是_____。
【答案】![]() 水和二氧化碳都不能使紫色石蕊变色 紫色石蕊试液遇酸变红,二氧化碳与水反应生成碳酸 将(Ⅳ)中变红的花进行烘烤
水和二氧化碳都不能使紫色石蕊变色 紫色石蕊试液遇酸变红,二氧化碳与水反应生成碳酸 将(Ⅳ)中变红的花进行烘烤
【解析】
(1)二氧化碳与水反应生成碳酸,化学方程式为:![]() ;
;
(2)(Ⅱ)和(Ⅲ)两个实验,可得出水和二氧化碳都不能使紫色石蕊变色;
(3)(I)和(Ⅳ)中小花都变成了红色,可以得出紫色石蕊试液遇酸变红,二氧化碳与水反应生成碳酸;
(4)证明碳酸是否稳定,可将(Ⅳ)中变色的花进行烘烤观察颜色是否又变为紫色,如果不变,证明较稳定,如果变为原来紫色,说明碳酸分解了,不稳定。

【题目】2019年12月17日我国第一艘国产航空母舰山东舰在某军港交付海军。航空母舰的餐厅里有一道士兵们喜欢吃的菜“锡纸烤鱼”,小华学习了金属的相关性质知识后,就想了解究竟什么是“锡纸?据此,小华查阅资料获得以下内容:
(查阅资料)
i.最初的锡纸是金属锡压延生产的,用于包裹食物,因其熔点较低不可加热,或加热温度到160℃以上就开始脆化——而限制了它在食品包装方面的使用,如需要烧烤食品,烘焙食品时就无法使用锡纸。
ii.铝箔纸,是金属铝压延生产的,也有人称为“锡纸,因其熔点较高加热到660℃以上才开始熔化,可以适用于普通烧烤食品,烘熔食品,干净卫生而同时又保持原有风味。故后来铝价降低后,铝箱取代了锡纸在日常生活中出现。
(得出结论)无论是锡纸,还是铝箱纸,在压延成型过程中,都利用了金属的__________。
(实验探究)“锡纸”中的金属成分是锡或铝?
(信息卡片)①锌粉是一种深灰色固体
②锡(Sn)与酸或金属化合物溶液反应生成+2价锡的化合物
(提出猜想)猜想1:“锡纸”中的金属是锡
猜想Ⅱ:“锡纸”中的金属是铝
(进行实验)设计方案并进行实验
实验操作 | 实验现象 | 实验分析与结论 |
取打磨后的“锡纸”片放入试管中,滴加氯化锌溶液 | “锡纸”表面有深灰色固体析出 | 根据实验现象,结合金属活动性顺序,可知猜想______(填“I”或“Ⅱ”)成立;反应的化学方程式为__________ |
(交流讨论)
(1)实验中打磨“锡纸”的目的是_________
(2)下列物质的溶液可以替代氯化锌溶液完成上述实验的是_______(填字母序号)
A 氯化铜 B 硝酸银 C 硫酸钠 D 硫酸亚铁
(实验小结)判断金属与金属化合物溶液的置换反应能否发生:在金属活动性顺序里,位于___________从它们的化合物的溶液里置换出来(K、Ca、Na除外)。
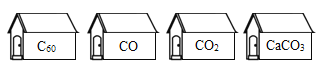
【题目】化学是研究物质变化规律的科学。甲图为物质转换关系,乙图所示为相关实验装置,请按要求完成下列问题:
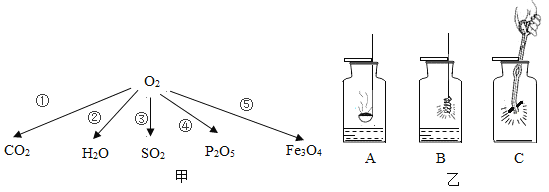
甲图序号 | 乙图装置选择 | 反应化学方程式 | 问题分析 |
① | C | _____ | 燃烧产物中有时会有CO生成,原因是:_____ |
② | _____ | 反应发生的条件是:_____ | |
③ | A | _____ | 实验时瓶中水的作用是:_____ |
④ | _____ | _____ | 将燃着的红磷熄灭,可进行的操作是:_____ |
⑤ | _____ | _____ | 若该实验未成功,原因可能是:_____ |
总结 | 甲图涉及的反应都是_____反应。 | ||
【题目】小明同学发现上个月做实验用的氢氧化钠溶液忘记了盖瓶盖,对于该溶液是否变质,小明邀约几个喜欢探究的同学对此进行了探究。请你一起完成下列实验报告。
(1)(提出问题1)该溶液是否变质?
(实验探究1)
实验步骤 | 实验现象 | 解释与结论 |
取少量该溶液放于试管中,滴加足量稀盐酸 | 有____产生 | 说明该溶液已变质,变质的原因是____(请用化学方程式表示) |
(2)(提出问题2)该溶液变质程度怎样?
(提出猜想)
猜想一:已完全变质,该溶液中溶质只含Na2CO3
猜想二:部分变质,该溶液中溶质含有____。
(查阅资料)氯化钡溶液呈中性。
(实验探究2)
实验步骤 | 实验现象 | 结论 |
先取少量该溶液放于试管中,加入过量氯化钡溶液 | 有____生成 | 猜想____成立 |
静置,取上层清液于另一支试管中,加入2-3滴酚酞溶液 | 上层清液变红 |
(3)(反思交流)在(实验探究2)中加入过量的氯化钡溶液的目的是什么?____
【题目】为探究化学反应前后,反应物与生成物之间的质量关系,三位同学分别做了以下三个实验:
实验一:称量镁条,点燃,待反应结束后再称量生成物质量。
实验二:将装有稀盐酸的小试管放入装有碳酸钙粉末的烧杯中称量,然后将盐酸倒出与碳酸钙粉末接触,过一会儿将试管放回烧杯中一起称量。
实验三:将装有氢氧化钠溶液的试管放入盛有硫酸铜溶液的烧杯中称量,然后将两种溶液混合,过一会儿将试管放回烧杯中一起称量。(化学方程式为:![]() )
)
实验数据见表:
实验一 | 实验二 | 实验三 | |
变化前 | 4.8g | 112.6g | 118.4g |
变化后 | 8.0g | 112.4g | 118.4g |
(1)写出实验二中发生反应的化学方程式___________________。
(2)这三个实验中,实验_________的数据能正确地反映了反应物与生成物之间的质量关系。实验一不能正确反映出反应物和生成物之间质量关系,原因是_________。
(4)同学们改进实验装置后,用镁条重做了实验,还发现产物中有少量黄色固体。
(提出问题)黄色固体是什么?
(查阅资料)
①氧化镁为白色固体。
②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,氨气有刺激性气味,该气体能使湿润的红色石落试纸变蓝。
(做出猜想)黄色固体是Mg3N2。
(实验探究)
进行实验:取少量黄色固体于试管中,加入适量水,把润的红色石蕊试纸放在试管口;
实验现象:生成有刺激性气味的气体,湿润的红色石蕊试纸由红色变______,同学们分析后,大家一致认为:黄色固体是Mg3N2。
(反思与交流)
空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是:_______________。