题目内容
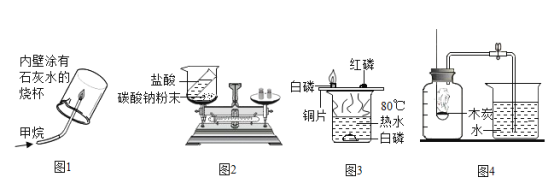
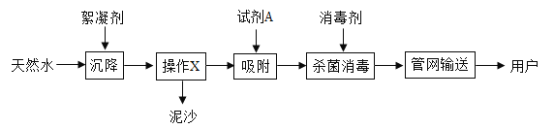
【题目】下列是初中化学实验室用于气体制取的发生装置与收集装置.根据实验装置图示回答下列问题:

(1)写出图中标号仪器名称①________________,②_________________。
(2)实验室制取二氧化碳时,发生装置可以选用B,发生反应的化学方程式为___________________。收集装置选用_______________ (填装置编号,下同),只能用此装置收集的原因是__________________。
(3)实验室能用B和F装置制取的气体是_______________,发生反应的化学方程式为___________________,如将发生装置B改成D,其优点是_________________。
(4)实验室如用氯酸钾和二氧化锰制取氧气,应选用的发生装置是______________________,如要收集一瓶较纯净的氧气,则应选用的收集装置是_____________________。
(5)乙炔(C2H2) 通常情况下是一种无色无味、难溶于水、密度比空气小的气体。实验室常用电石(CaC2) 固体与水反应来制取,当电石与水接触时剧烈反应,产生大量的气体和热量,同时生成一种叫熟石灰的固体。据此,请回答下列问题。

①制取乙炔气体最好选用的发生装置是_______________,发生反应的化学方程式为:_______________________。
②如用如图装置来收集乙炔气体,则气体应从______________端(填a或b)。
【答案】分液漏斗 锥形瓶 CaCO3+2HCl=CaCl2+CO2↑+H2O G 二氧化碳能溶于水,密度比空气的密度大 氢气 Zn+H2SO4═ZnSO4+H2↑ 可以控制反应的发生与停止 A E C CaC2+2H2O═Ca(OH)2+C2H2↑ b
【解析】
(1)仪器①是分液漏斗,仪器②是锥形瓶,故填:分液漏斗;锥形瓶;
(2)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳;二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;故答案为: CaCO3+2HCl=CaCl2+CO2↑+H2O;G;二氧化碳能溶于水,密度比空气的密度大;
(3)实验室能用B和F装置制取的气体是氢气,锌和稀硫酸反应生成硫酸锌和氢气,发生反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑,如将发生装置B改成D,其优点是可以控制反应的发生与停止。故填:氢气;Zn+H2SO4═ZnSO4+H2↑;可以控制反应的发生与停止;
(4)实验室如用氯酸钾和二氧化锰制取氧气,因为反应物为固体,反应条件为加热,所以发生装置选A;氧气不易溶于水,可用排水法收集较纯净的氧气;故填:A;E;
(5)①实验室用电石(固体)与水反应制取乙炔.是固体和液体在常温下的反应,制取乙炔应最好选择的发生装置是C,电石(主要成分是CaC2)与水反应生成乙炔,同时生成氢氧化钙,化学方程式为:CaC2+2H2O═Ca(OH)2+C2H2↑;故填:C;CaC2+2H2O═Ca(OH)2+C2H2↑;
②如用如图装置来收集乙炔气体,乙炔难溶于水,则气体应从b端通入,故填:b。

 励耘书业暑假衔接宁波出版社系列答案
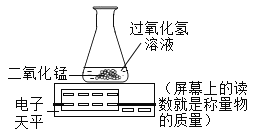
励耘书业暑假衔接宁波出版社系列答案【题目】某兴趣小组同学对实验室“过氧化氢分解制氧气”的条件进行了如下探究。
[探究活动1]探究催化剂的种类对过氧化氢分解速率的影响。
设计实验:小组同学设计下列对比实验,实验①:将30g10%过氧化氢溶液与1g二氧化锰均匀混合:实验②将xg 10%过氧化氢溶液与1g氧化铜均匀混合。
实验①中反应的化学方程式是_____;实验②中x的值应为_____。
[探究活动2]探究一些因素对过氧化氢分解速率的影响。
收集证据:小组同学通过实验采集到相关实验数据如下表。
过氧化氢溶液的质量 | 过氧化氢溶液的浓度 | 二氧化锰的质量 | 相同时间内产生氧气体积 | |
Ⅰ | 50. 0g | 1% | 0.1g | 9mL |
Ⅱ | 50. 0g | 2% | 0.1g | 16mL |
Ⅲ | 50. 0g | 4% | 0.1g | 31mL |
问题与讨论: (1) 本实验的结论是_____。
(2)实验时,测量氧气体积的装置应选择下图中_____(填编号)。
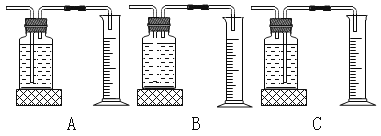
(3)小强同学设计了下图所示装置完成上述实验,通过比较相同时间内_____同样能获取该实验的结论。