题目内容

(2)将反应后的物质过滤,蒸干滤液后得到固体的质量.
(1)由图可知反应生成碳酸钙沉淀的质量是2克,消耗CaCl2溶液的质量是10克.
设CaCl2溶质的质量分数为x Na2CO3溶质的质量分数为y
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 111 100
20gy 10gx 2g
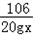 =
=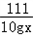 =
=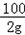 ,
,
x=22.2%,
y=10.6%
x:y=22.2%:10.6%=111:53
答:CaCl2溶液与Na2CO3溶液中溶质的质量分数之比为111:53;
(2)设反应后生成氯化钠的质量为z
Na2CO3+CaCl2=CaCO3↓+2NaCl
100 117
2g z
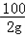 =
=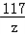 ,
,
z=2.34g
剩余氯化钙质量为:(15g﹣10g)× 22.2%=1.11g
蒸干滤液后得到固体的质量为:2.34g+1.11g=3.45(克)
答:蒸干滤液后得到固体的质量为3.45克.(其他解法合理且正确即可)

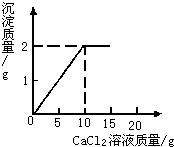 将15g CaCl2溶液逐滴加入到20g Na2CO3溶液中,并测得生成沉淀的质量与滴入CaCl2溶液的质量,其关系如图所示.
将15g CaCl2溶液逐滴加入到20g Na2CO3溶液中,并测得生成沉淀的质量与滴入CaCl2溶液的质量,其关系如图所示. 已知CaCl2+Na2CO3=CaCO3↓+2NaCl.将15g CaCl2溶液逐滴加入到20g Na2CO3溶液中,并测得生成沉淀的质量与滴入CaCl2溶液的质量关系如图所示.若将反应后的物质过滤,蒸干滤液后得到固体的质量是多少.
已知CaCl2+Na2CO3=CaCO3↓+2NaCl.将15g CaCl2溶液逐滴加入到20g Na2CO3溶液中,并测得生成沉淀的质量与滴入CaCl2溶液的质量关系如图所示.若将反应后的物质过滤,蒸干滤液后得到固体的质量是多少. (2005?北京)将15g CaCl2溶液逐滴加入到20g Na2CO3溶液中,并测得生成沉淀的质量与滴入CaCl2溶液的质量,其关系如图所示.请根据题意计算:
(2005?北京)将15g CaCl2溶液逐滴加入到20g Na2CO3溶液中,并测得生成沉淀的质量与滴入CaCl2溶液的质量,其关系如图所示.请根据题意计算: