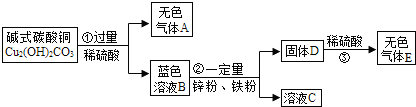
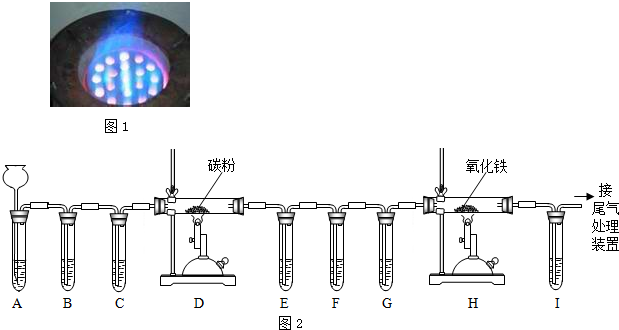
题目内容
(2011?顺义区一模)已知CaCl2+Na2CO3=CaCO3↓+2NaCl.将15g CaCl2溶液逐滴加入到20g Na2CO3溶液中,并测得生成沉淀的质量与滴入CaCl2溶液的质量关系如图所示.若将反应后的物质过滤,蒸干滤液后得到固体的质量是多少.
【答案】分析:根据生成沉淀的质量与滴入CaCl2溶液的质量关系图,加入10g氯化钙溶液时恰好完全反应,因此所加的15g氯化钙溶液其中有5g溶液过量,则蒸干滤液后得到固体为剩余氯化钙溶液中的氯化钙和反应生成的氯化钠;根据反应化学方程式,由生成沉淀的质量可计算生成氯化钠的质量,还需要计算出此时消耗氯化钙的质量以确定剩余氯化钙的质量.
解答:解:设反应后生成NaCl的质量为z,参加反应的CaCl2的质量为x
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100 117
x 2g z
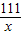 =
=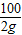 =
=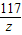 ,
,
z=2.34g
x=2.22g
所加CaCl2溶液的溶质质量分数= ×100%=22.2%
×100%=22.2%
剩余CaCl2的质量=(15g-10g)×22.2%=1.11g
蒸干滤液后得到固体的质量为:2.34g+1.11g=3.45g
答:若将反应后的物质过滤,蒸干滤液后得到固体的质量是3.45g.
(其他解法合理且正确均给分)
点评:根据表示变化的曲线,曲线折点即两物质恰好完全反应,生成沉淀质量达到最大值,其后所加溶液不再发生反应.
解答:解:设反应后生成NaCl的质量为z,参加反应的CaCl2的质量为x
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100 117
x 2g z
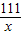 =
=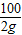 =
=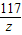 ,
,z=2.34g
x=2.22g
所加CaCl2溶液的溶质质量分数=
 ×100%=22.2%
×100%=22.2%剩余CaCl2的质量=(15g-10g)×22.2%=1.11g
蒸干滤液后得到固体的质量为:2.34g+1.11g=3.45g
答:若将反应后的物质过滤,蒸干滤液后得到固体的质量是3.45g.
(其他解法合理且正确均给分)
点评:根据表示变化的曲线,曲线折点即两物质恰好完全反应,生成沉淀质量达到最大值,其后所加溶液不再发生反应.

练习册系列答案
相关题目