题目内容
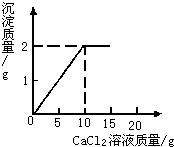 将15g CaCl2溶液逐滴加入到20g Na2CO3溶液中,并测得生成沉淀的质量与滴入CaCl2溶液的质量,其关系如图所示.
将15g CaCl2溶液逐滴加入到20g Na2CO3溶液中,并测得生成沉淀的质量与滴入CaCl2溶液的质量,其关系如图所示.请根据题意计算:
(1)CaCl2溶液与Na2CO3溶液中溶质的质量分数之比.
(2)将反应后的物质过滤,蒸干滤液后得到固体的质量.
分析:由题意可知CaCl2和Na2CO3反应生成的沉淀为碳酸钙,化学反应的方程式是:Na2CO3+CaCl2=CaCO3↓+2NaCl.根据关系图,可知生成沉淀为碳酸钙2克,需要消耗CaCl2溶液的质量是10克.根据十字交叉法即可得到各物质反应量的关系式.
解答:解:(1)由图可知反应生成碳酸钙沉淀的质量是2克,消耗CaCl2溶液的质量是10克.
设CaCl2溶质的质量分数为x Na2CO3溶质的质量分数为y
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 111 100
20gy 10gx 2g
=
=
,
x=22.2%,
y=10.6%
x:y=22.2%:10.6%=111:53
(2)设反应后生成氯化钠的质量为z
Na2CO3+CaCl2=CaCO3↓+2NaCl
100 117
2g z
=
,z=2.34g
剩余氯化钙质量为:(15g-10g)×22.2%=1.11g
蒸干滤液后得到固体的质量为:2.34g+1.11g=3.45(克)
答:CaCl2溶液与Na2CO3溶液中溶质的质量分数之比为111:53;
将反应后的物质过滤,蒸干滤液后得到固体的质量为3.45克.
(其他解法合理且正确即可)
设CaCl2溶质的质量分数为x Na2CO3溶质的质量分数为y
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 111 100
20gy 10gx 2g
| 106 |
| 20gy |
| 111 |
| 10gx |
| 100 |
| 2g |
x=22.2%,
y=10.6%
x:y=22.2%:10.6%=111:53
(2)设反应后生成氯化钠的质量为z
Na2CO3+CaCl2=CaCO3↓+2NaCl
100 117
2g z
| 100 |
| 2g |
| 117 |
| z |
剩余氯化钙质量为:(15g-10g)×22.2%=1.11g
蒸干滤液后得到固体的质量为:2.34g+1.11g=3.45(克)
答:CaCl2溶液与Na2CO3溶液中溶质的质量分数之比为111:53;
将反应后的物质过滤,蒸干滤液后得到固体的质量为3.45克.
(其他解法合理且正确即可)
点评:本题主要考查化学方程式的计算,解此类问题的关键就是写正确物质反应的化学方程式.根据化学方程式找出已知量和未知量的之间关系,然后,根据这个关系列比例式求解.

练习册系列答案
相关题目
 已知CaCl2+Na2CO3=CaCO3↓+2NaCl.将15g CaCl2溶液逐滴加入到20g Na2CO3溶液中,并测得生成沉淀的质量与滴入CaCl2溶液的质量关系如图所示.若将反应后的物质过滤,蒸干滤液后得到固体的质量是多少.
已知CaCl2+Na2CO3=CaCO3↓+2NaCl.将15g CaCl2溶液逐滴加入到20g Na2CO3溶液中,并测得生成沉淀的质量与滴入CaCl2溶液的质量关系如图所示.若将反应后的物质过滤,蒸干滤液后得到固体的质量是多少. (2005?北京)将15g CaCl2溶液逐滴加入到20g Na2CO3溶液中,并测得生成沉淀的质量与滴入CaCl2溶液的质量,其关系如图所示.请根据题意计算:
(2005?北京)将15g CaCl2溶液逐滴加入到20g Na2CO3溶液中,并测得生成沉淀的质量与滴入CaCl2溶液的质量,其关系如图所示.请根据题意计算:
