题目内容
【题目】某项目学习小组用鸡蛋壳进行了如下探究。(鸡蛋壳主要成分是 CaCO3,其他 成分对实验的影响忽略不计)。
(实验回顾)鸡蛋沉浮 将一个新鲜的鸡蛋放在盛有足量稀盐酸的烧杯中,可观察到鸡蛋一边冒气泡一边沉到杯底,一会儿又慢慢上浮,到接近液面时又下沉。将蘸有澄清石灰水的玻璃片盖在烧杯上,石灰水 变浑浊。
(1)鸡蛋出现沉浮现象的原因是______。
(2)石灰水变浑浊的原因是______(用化学方程式表示)。
(实验探究 1)鸡蛋壳溶解 查资料知:电导率越大,溶液导电性越强,离子浓度越大。
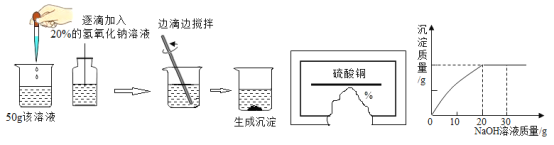
实验设计:在 20℃时,在烧杯中加入蒸馏水,插入电导率传感器,加入蛋壳粉,搅拌,测得 电导率随时间的变化如图 1。
由图 1 可知,下列说法中正确的是______(填字母)。
Aa-b 段说明蒸馏水中含有极少量的 H+和 OH-
Bb-c 段说明蛋壳中的碳酸钙在水中解离出 Ca2+和 CO32-
Cc-d 段说明溶质溶解逐渐达到饱和,离子浓度基本不变
(实验探究 2)鸡蛋壳代替牙齿探究含氟牙膏能否预防龋齿 查资料知:鸡蛋壳、牙齿与含氟牙膏反应的化学原理相似。
(1)氟元素是人体必需的______(填“常量元素”或“微量元素”)。
(2)含氟牙膏(含氟成分为 NaF)与鸡蛋壳中碳酸钙能发生复分解反应,形成更难溶的氟 化钙保护层,反应的化学方程式为______。
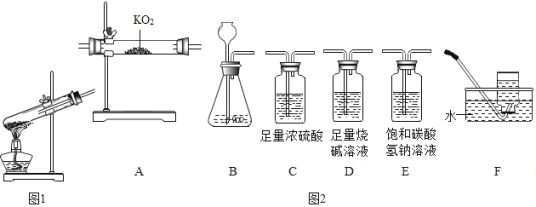
实验设计:先检查图 2 装置气密性,方法是_______。再称取 0.50g“牙膏处理过的蛋壳(用牙膏液浸泡、洗涤、晾干)”于锥形瓶中,用注射器抽 20mL3.5%的盐酸(模拟形成龋齿的酸性环境),连接好装置,打开开关,将盐酸快速压入锥形 瓶,关闭开关;再用“未用牙膏处理过的蛋壳”,重复上述实验。测得压强随时间的变化如 图 3 所示。
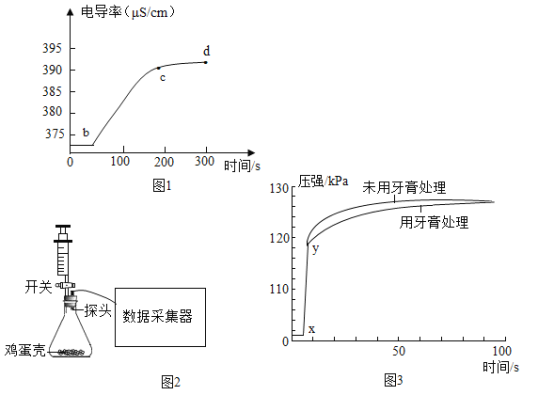
(交流与反思)根据图 3 的数据分析,含氟牙膏能否预防龋齿,为什么?______。
(拓展应用)某同学称取 6g 蛋壳粉加入足量的稀盐酸反应,测得产生的二氧化碳质量为2.2g。计算蛋壳中碳酸钙的质量分数。(写出计算过程,结果保留 0.1%)______
【答案】鸡蛋的重力比受到的浮力大,下沉,随着蛋壳表面气泡增多,鸡蛋受到的浮力增大,浮力大于重力时上浮,到接近液面时部分气泡破裂,重力大于浮力又下沉 Ca(OH)2+CO2=CaCO3↓+H2O ABC 微量元素 2NaF+CaCO3=CaF2+Na2CO3 连接装置,外拉注射器活塞,松手后活塞回到原处,说明装置不漏气 能,单位时间内用牙膏处理过的蛋壳产生二氧化碳较少 83.3%
【解析】
[实验回顾]
(1)鸡蛋出现沉浮现象的原因是:鸡蛋的重力比受到的浮力大,下沉,随着蛋壳表面气泡增多,鸡蛋受到的浮力增大,浮力大于重力时上浮,到接近液面时部分气泡破裂,重力大于浮力又下沉。
故填:鸡蛋的重力比受到的浮力大,下沉,随着蛋壳表面气泡增多,鸡蛋受到的浮力增大,浮力大于重力时上浮,到接近液面时部分气泡破裂,重力大于浮力又下沉。
(2)石灰水变浑浊的原因:二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式:Ca(OH)2+CO2═CaCO3↓+H2O。
故填:Ca(OH)2+CO2═CaCO3↓+H2O。
[实验探究 1]
A a-b 段说明蒸馏水中含有极少量的 H+和 OH-,选项A正确;
B b-c 段说明蛋壳中的碳酸钙在水中解离出 Ca2+和 CO32-,选项B正确;
C c-d 段说明溶质溶解逐渐达到饱和,离子浓度基本不变,选项C正确。
故填:ABC。
[实验探究 2]
(1)氟元素是人体必需的微量元素。故填:微量元素。
(2)氟化钠和碳酸钙反应生成氟化钙和碳酸钠,反应的化学方程式:2NaF+CaCO3═CaF2+Na2CO3。
检查图 2 装置气密性的方法:连接装置,外拉注射器活塞,松手后活塞回到原处,说明装置不漏气。故填:2NaF+CaCO3═CaF2+Na2CO3;连接装置,外拉注射器活塞,松手后活塞回到原处,说明装置不漏气。
[交流与反思]
根据图 3 的数据分析,含氟牙膏能预防龋齿,这是因为单位时间内用牙膏处理过的蛋壳产生二氧化碳较少。故填:能,单位时间内用牙膏处理过的蛋壳产生二氧化碳较少。
[拓展应用]
设碳酸钙质量为x

![]() x=5g,
x=5g,
蛋壳中碳酸钙的质量分数是:![]()
答:蛋壳中碳酸钙的质量分数是83.3%。

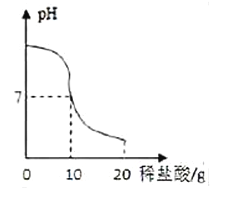
【题目】将20.0g稀盐酸逐滴加入到10.0g溶质质量分数为40%的氢氧化钠溶液中,边滴加边搅拌,随着稀盐酸的滴加,溶液的pH变化情况如图所示,溶液的温度变化如表所示(不考虑反应过程中热量散失)
反应时间(s) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
溶液温度(℃) | 20.5 | 20.6 | 20.7 | 20.8 | 20.9 | 20.8 | 20.7 |
(1)当稀盐酸与氢氧化钠溶液恰好完全反应时,溶液的温度是_____℃
(2)计算稀盐酸中溶质的质量分数_________(精确到0.1%)
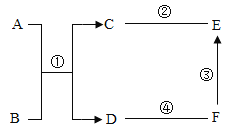
【题目】常温下,下表物质符合图中转化关系的是( )
选项 | 甲 | 乙 | 丙 | 转化关系图 |
A | CaCO3 | Ca(OH)2 | CaCl2 |
|
B | CuO | H2O | O2 | |
C | NaCl | NaNO3 | NaOH | |
D | CO2 | H2O | H2CO3 |
A.AB.BC.CD.D