题目内容
【题目】为了解甲酸的分解产物,实验小组进行了以下探究:
(查阅资料)甲酸(HCOOH)的熔点为8.6℃,能分解生成两种物质。浓硫酸具有吸水性,能做干燥剂。
(提出猜想) 实验小组对甲酸的分解产物提出了猜想:
猜想1. H2和CO2; 猜想2. CO和H2O。
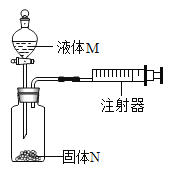
(设计实验)20℃时,甲酸的状态为______;从图一装置中选择合适的装置______(填序号)对甲酸进行加热。为了加快分解速率,实验小组加入了催化剂,反应后将分解产物通入图二装置进行实验。
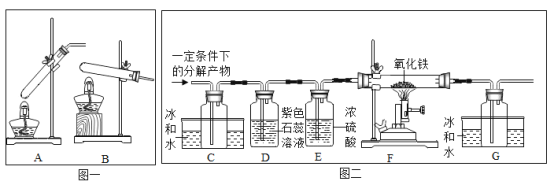
(实验预测)若猜想l成立,则D中的实验现象应为______。产生该现象的原因是(用化学方程式表示)_____________________。若实验中观察到C处瓶内出现大量水珠,则F处玻璃管中出现的现象为_____,甲酸分解的化学方程式为________________。
(交流拓展)(1)小雪认为该设计有一个缺陷,是____________________。
(2)资料表明,不同条件下,甲酸的分解产物不同,猜想1和猜想2均能成立。据此小畅对甲酸的分解产物又提出新猜想: 猜想3. H2O和C; 猜想4. H2O和CO2; 猜想5.H2和CO, 经讨论大家认为无需进行实验就能确定猜想3、猜想4和猜想5都错误,理由是_______。
【答案】液态 A 紫色石蕊溶液变成红色 H2O+CO2=H2CO3 红色粉末变成黑色 HCOOH CO↑+H2O 没有处理尾气 不符合质量守恒定律或化学变化前后原子的种类和数目不变
CO↑+H2O 没有处理尾气 不符合质量守恒定律或化学变化前后原子的种类和数目不变
【解析】
[设计实验]
甲酸(HCOOH)的熔点为8.6℃,20℃时,甲酸的状态为液态,因此应该选择装置A对甲酸进行加热。故填:液态;A
[实验预测]
若猜想l成立,则D中二氧化碳和水反应生成碳酸,碳酸显酸性,能使石蕊试液变红色;二氧化碳和水反应的化学方程式为:CO2+H2O═H2CO3。故填:紫色石蕊溶液变成红色;CO2+H2O═H2CO3
[进行实验]
实验中观察到C处瓶内出现大量水珠,说明生成了水,如果反应生成了水,则生成物的另一种是一氧化碳,高温条件下一氧化碳和氧化铁反应生成铁和二氧化碳,因此F处玻璃管中出现的现象为红色固体变成黑色固体;所发生反应的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2;甲酸分解生成一氧化碳和水,反应的化学方程式为:HCOOH
2Fe+3CO2;甲酸分解生成一氧化碳和水,反应的化学方程式为:HCOOH CO↑+H2O。故填:红色固体变成黑色固体;HCOOH
CO↑+H2O。故填:红色固体变成黑色固体;HCOOH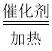 CO↑+H2O
CO↑+H2O
[交流拓展]
(1)由于草酸分解产生一氧化碳,会污染空气,而装置没有对尾气进行处理,故存在的缺陷是没有处理尾气;处理尾气可以在G装置后放置一盏点燃的酒精灯。故填:没有处理尾气
(2)无需进行实验就能确定猜想3、猜想4和猜想5都错误,理由是:甲酸、二氧化碳中碳原子和氧原子个数比是1:2,如果生成水则不能生成碳,如果生成二氧化碳则不能生成水,如果生成一氧化碳则不能生成氢气,均不符合质量守恒定律或化学变化前后原子的种类和数目不变。故填:不符合质量守恒定律或化学变化前后原子的种类和数目不变

 走进文言文系列答案
走进文言文系列答案【题目】在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如表所示,下列说法不正确的是( )
物质 | X | Y | Z | W |
反应前质量/g | 10 | 3 | 90 | 0 |
反应后质量/g | 3.2 | 3 | 待测 | 3.2 |
A. W可能是单质 B. Y可能是催化剂
C. 该反应是分解反应 D. 反应后Z物质的质量为![]()