题目内容
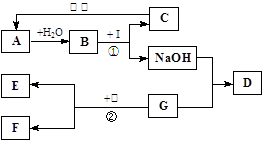
民间流传用硝土和草木灰作原料来制取硝酸钾.硝土中含有硝酸钙和氯化钠物质,草木灰的主要成分是碳酸钾.制作的工艺流程主要如图所示:
(1)③⑤⑦均为操作X,该操作是 ;
(2)结合图,分析工艺流程中用加热蒸发方法得到氯化钠晶体,而用冷却结晶法得到硝酸钾晶体的原因 .
(3)写出生成白色沉淀B的化学方程式: .
(4)用含硝酸钙为50%的硝土40kg与草木灰混合,按上述工艺流程,理论上能制取硝酸钾的质量是 kg(保留1位小数).
(5)溶液D可以重复使用的原因是 .
⑴过滤
⑵NaCl的溶解度受温度变化的影响较小,而KNO3的溶解度受温度变化的影响较大
⑶Ca(NO3)2+K2CO3═CaCO3↓+2KNO3
⑷24.6
⑸滤液中仍有较多的KNO3
解析试题分析:硝土中含有硝酸钙和氯化钠物质,草木灰的主要成分是碳酸钾,加水搅拌,硝酸钙与碳酸钾反应生成碳酸钙沉淀和硝酸钾,经“过滤”除掉碳酸钙沉淀;氯化钠和硝酸钾混合溶液A加热蒸发,“过滤”得氯化钠和热溶液C硝酸钾,硝酸钾热溶液冷却至室温“过滤”得硝酸钾晶体和溶液D(溶质为硝酸钾),再回收利用。
(1)③⑤⑦均为操作X,该操作是将固体和液体分开,为过滤;
(2)由溶解度的曲线图可知:NaCl的溶解度受温度变化的影响较小,用加热蒸发方法得到氯化钠晶体;而KNO3的溶解度受温度变化的影响较大,用冷却结晶法得到硝酸钾晶体;
(3)硝土中含有硝酸钙和氯化钠物质,草木灰的主要成分是碳酸钾,加水搅拌,硝酸钙与碳酸钾反应生成碳酸钙沉淀和硝酸钾;正确书写此反应的化学方程式;
(4)已知硝酸钙为50%的硝土40kg,则硝酸钙为20kg,根据化学方程式Ca(NO3)2+K2CO3═CaCO3↓+2KNO3利用反应的质量比可求出理论上能制取硝酸钾的质量;
(5)硝酸钾热溶液冷却知室温得硝酸钾晶体和溶液D(溶质为硝酸钾),溶液D还有较多的硝酸钾,故可重复利用。
考点:常见的化学反应、利用化学方程式的计算、物质的分类和提纯

(9分)我国制碱工业的先驱侯德榜将制碱与制氨结合起来的联合制碱法,为纯碱和氮肥工业技术的发展做出了杰出的贡献。其生产工艺流程示意图如下:
【资料】四种盐在不同温度下的溶解度表
| | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | —— | —— |
| NaHCO3 | 8.1 | 9.6 | 11.1 | 12.7 | —— |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
⑵操作a是 ,生产流程中被循环利用的物质是 ;
⑶在精盐水中先通入NH3,使溶液呈 性,再通入CO2,有利于对CO2的吸收;
⑷氨盐水中通入二氧化碳后,在常温条件下,易析出NaHCO3晶体而不析出NH4Cl晶体的可能原因是 ;
⑸粗盐水中主要含有CaCl2、MgCl2等杂质,工业上常加入下列物质除杂、精制,则加入下列三种试剂合理的顺序为 (填序号);
A.适量的盐酸 B.稍过量的Na2CO3溶液 C.稍过量的Ca(OH)2溶液
⑹副产品NH4Cl可做 肥,若加入氢氧化钠加热,反应的化学方程式为 。
一包白色粉末A由CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的三种混合而成。为探究其组成,进行以下实验:
分析实验过程,回答:
①白色粉末A中一定有(8),一定没有(9);可能含有的物质是(10) 生成无色气体E的化学方程式是(11)。
② 对可能含有的物质,通过如下实验进一步确认:
| 实验操作 | 实验现象 | 实验结论 |
| 取未知成分溶液D少许,加入(12)溶液, | (13) | (14)。 |
下图装置可用来测定空气中氧气的含量。对该实验认识不正确的是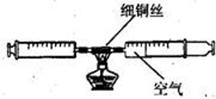
| A.铜丝的量不足会影响实验结论 |
| B.装置不漏气是实验成功的重要因素之一 |
| C.加热完后应立即观察体积变化,并记录实验数据 |
| D.实验中反复推拉针管可使反应物充分接触,使氧气完全反应 |
下列化学实验能够成功的是
| A.小明用木炭代替红磷做测定空气中氧气含量的实验 |
| B.小颖用锌、铁、铜和稀盐酸确定锌、铁、铜三种金属的活动性 |
| C.小聪在20℃配制36%的氯化钠溶液(20℃时氯化钠的溶解度为36 g) |
| D.小青将过量的木炭粉和少量氧化铜粉的混合物置于蒸发皿里加强热,得到纯净的铜 |