题目内容
【题目】早在春秋战国时期,我国就开始生产和使用铁器。工业炼铁把铁矿石和焦炭、石灰石一起加入高炉,在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。
(1)一氧化碳还原氧化铁的化学方程式为:。其中,石灰石起的作用是。
(2)(一)甲组同学在学习炼铁的相关内容时,对炼铁时还原剂的选择进行了如下探究。
【提出问题】
单质碳也具有还原性,碳还原氧化铁的化学方程式为。为什么工业上不用焦炭作为还原剂直接还原铁矿石?
(3)【猜想与假设】
焦炭和铁矿石都是固体,接触面积小,反应不易完全。
【进行实验】
①称取两份相同质量的氧化铁粉末。一份与足量的碳粉均匀混合放入图1装置A的试管中;另一份放入图1装置B的玻璃管中。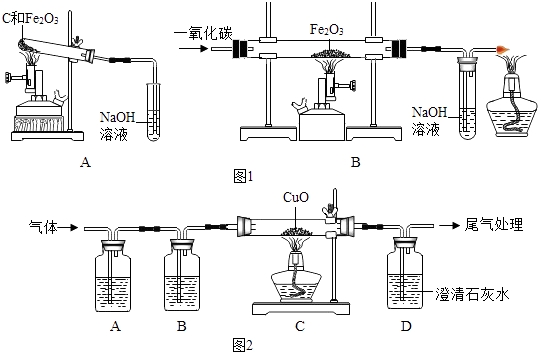
②图1装置A和B两组实验同时开始进行。在图1装置B的反应中,实验开始前应先(选填“通CO”或“加热”); 实验结束后应继续通入CO直至冷却至室温,其原因是。
(4)【实验现象】
当图1装置B的玻璃管中固体完全由时(选填“红色变为黑色”或“黑色变为红色”),图1装置A的试管中仍有。
(5)【解释与结论】
焦炭和铁矿石都是固体,接触面积小,反应确实不易完全,这可能是工业上不用焦炭作为还原剂直接还原铁矿石的一个原因。
【完善实验】
联想到单质碳的一些化学性质,甲同学认为在碳还原氧化铁的反应中可能还会有CO产生。为了证明碳还原氧化铁所得的气体中含有CO和CO2 , 将该气体通过图2的检验装置。图2A装置中的试剂是(写名称,下同) , 图2B装置中的试剂是氢氧化钠溶液,用以吸收二氧化碳(2NaOH+CO2═Na2CO3+H2O );证明原混合气体中CO2存在的化学方程式;证明原混合气体中CO存在的实验现象是;经过检验,证实碳还原氧化铁所得的气体中确实含有CO和CO2。
(6)(二)精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
【物质制备】
利用绿矾制备精还原铁粉的工艺流程如下:![]()
粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为FexOy+yH2 ![]() xFe+yH2O,Fe3C+2H2
xFe+yH2O,Fe3C+2H2 ![]() 3Fe+CH4。
3Fe+CH4。
【含量测定】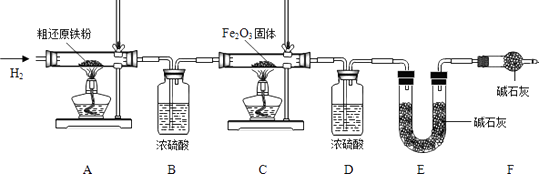
为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按图装置进行实验。
已知3CH4+4Fe2O3 ![]() 3CO2+6H2O+8Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
3CO2+6H2O+8Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;
②缓缓通入纯净干燥的H2;
③点燃酒精灯,(填“先点A处,后点C处”或“先点C处,后点A处”);
④分别熄灭A处、C处酒精灯;
⑤再缓缓通入少量H2;
⑥再次称量必要装置的质量
(7)步骤②的目的是 , 验证该步骤目的达到的实验方法是;
(8)若缺少装置D,则所测氧元素的质量分数将(填“偏大”,“偏小”或“不变”)。
(9)粗还原铁粉样品的质量为15.000g,装置B、E分别增重0.270g和0.330g,则计算样品出中碳、氧元素的质量分数分别是。(列出计算过程)
【答案】
(1)3CO+Fe2O3 ![]() 2Fe+3CO2,将矿石中的二氧化硅等杂质转变为炉渣而除去的
2Fe+3CO2,将矿石中的二氧化硅等杂质转变为炉渣而除去的
(2)3C+2Fe2O3![]() 4Fe+3CO2↑
4Fe+3CO2↑
(3)通CO,防止液体倒吸进入硬质粗玻璃管,造成炸裂且防止高温下铁又被进入的空气氧化
(4)红色变为黑色,红色物质
(5)澄清石灰水,Ca(OH)2+CO2=CaCO3↓+H2O,黑色粉末变成红色
(6)先点C处,后点A处
(7)排尽空气,防止爆炸,收集尾气,进行验纯
(8)不变
(9)解:粗还原铁粉样品的质量为15.000g,装置B、E分别增重0.270g和0.330g,则计算样品出中碳、氧元素的质量分数分别是∶0.330g×﹙12/44×100%﹚/15.0g×100%=0.6%;0.270g×﹙16/18×100%﹚/15.0g×100%=1.6%。
【解析】解:根据所学知识和题中信息知,工业炼铁把铁矿石和焦炭、石灰石一起加入高炉,在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。一氧化碳还原氧化铁的化学方程式为:3CO+Fe2O3![]() 2Fe+3CO2;其中,石灰石起的作用是将矿石中的二氧化硅等杂质转变为炉渣而除去的。(一)甲组同学在学习炼铁的相关内容时,对炼铁时还原剂的选择进行了如下探究。【提出问题】单质碳也具有还原性,碳还原氧化铁的化学方程式为3C+2Fe2O3
2Fe+3CO2;其中,石灰石起的作用是将矿石中的二氧化硅等杂质转变为炉渣而除去的。(一)甲组同学在学习炼铁的相关内容时,对炼铁时还原剂的选择进行了如下探究。【提出问题】单质碳也具有还原性,碳还原氧化铁的化学方程式为3C+2Fe2O3![]() 4Fe+3CO2↑。为什么工业上不用焦炭作为还原剂直接还原铁矿石?【猜想与假设】焦炭和铁矿石都是固体,接触面积小,反应不易完全。【进行实验】①称取两份相同质量的氧化铁粉末。一份与足量的碳粉均匀混合放入图1装置A的试管中;另一份放入图1装置B的玻璃管中。②图1装置A和B两组实验同时开始进行。在图1装置B的反应中,实验开始前应先通CO;实验结束后应继续通入CO直至冷却至室温,其原因是防止液体倒吸进入硬质粗玻璃管,造成炸裂且防止高温下铁又被进入的空气氧化。【实验现象】当图1装置B的玻璃管中固体完全由红色变为黑色时;图1装置A的试管中仍有红色物质。【解释与结论】焦炭和铁矿石都是固体,接触面积小,反应确实不易完全,这可能是工业上不用焦炭作为还原剂直接还原铁矿石的一个原因。【完善实验】甲同学认为在碳还原氧化铁的反应中可能还会有CO产生。为了证明碳还原氧化铁所得的气体中含有CO和CO2,将该气体通过图2的检验装置。图2A装置中的试剂是澄清石灰水;图2B装置中的试剂是氢氧化钠溶液,用以吸收二氧化碳(2NaOH+CO2═Na2CO3+H2O );证明原混合气体中CO2存在的化学方程式是Ca(OH﹚2+CO2=CaCO3↓+H2O;证明原混合气体中CO存在的实验现象是黑色粉末变成红色。经过检验,证实碳还原氧化铁所得的气体中确实含有CO和CO2。(二)精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:【物质制备】利用绿矾制备精还原铁粉的工艺流程如下:粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为FexOy+yH2
4Fe+3CO2↑。为什么工业上不用焦炭作为还原剂直接还原铁矿石?【猜想与假设】焦炭和铁矿石都是固体,接触面积小,反应不易完全。【进行实验】①称取两份相同质量的氧化铁粉末。一份与足量的碳粉均匀混合放入图1装置A的试管中;另一份放入图1装置B的玻璃管中。②图1装置A和B两组实验同时开始进行。在图1装置B的反应中,实验开始前应先通CO;实验结束后应继续通入CO直至冷却至室温,其原因是防止液体倒吸进入硬质粗玻璃管,造成炸裂且防止高温下铁又被进入的空气氧化。【实验现象】当图1装置B的玻璃管中固体完全由红色变为黑色时;图1装置A的试管中仍有红色物质。【解释与结论】焦炭和铁矿石都是固体,接触面积小,反应确实不易完全,这可能是工业上不用焦炭作为还原剂直接还原铁矿石的一个原因。【完善实验】甲同学认为在碳还原氧化铁的反应中可能还会有CO产生。为了证明碳还原氧化铁所得的气体中含有CO和CO2,将该气体通过图2的检验装置。图2A装置中的试剂是澄清石灰水;图2B装置中的试剂是氢氧化钠溶液,用以吸收二氧化碳(2NaOH+CO2═Na2CO3+H2O );证明原混合气体中CO2存在的化学方程式是Ca(OH﹚2+CO2=CaCO3↓+H2O;证明原混合气体中CO存在的实验现象是黑色粉末变成红色。经过检验,证实碳还原氧化铁所得的气体中确实含有CO和CO2。(二)精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:【物质制备】利用绿矾制备精还原铁粉的工艺流程如下:粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为FexOy+yH2![]() xFe+yH2O,Fe3C+2H2
xFe+yH2O,Fe3C+2H2![]() 3Fe+CH4。【含量测定】为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按图装置进行实验。已知3CH4+4Fe2O3
3Fe+CH4。【含量测定】为得到精还原铁粉并测定粗还原铁粉中氧和碳元素的质量分数,按图装置进行实验。已知3CH4+4Fe2O3![]() 3CO2+6H2O+8Fe(6)主要实验步骤如下:①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;②缓缓通入纯净干燥的H2;③点燃酒精灯,先点C处,后点A处。④分别熄灭A处、C处酒精灯;⑤再缓缓通入少量H2;⑥再次称量必要装置的质量。(7)步骤②的目的是排尽空气,防止爆炸;验证该步骤目的达到的实验方法是收集尾气,进行验纯。(8)若缺少装置D,则所测氧元素的质量分数将不变。
3CO2+6H2O+8Fe(6)主要实验步骤如下:①按顺序组装仪器,检查装置的气密性,称量样品和必要装置的质量;②缓缓通入纯净干燥的H2;③点燃酒精灯,先点C处,后点A处。④分别熄灭A处、C处酒精灯;⑤再缓缓通入少量H2;⑥再次称量必要装置的质量。(7)步骤②的目的是排尽空气,防止爆炸;验证该步骤目的达到的实验方法是收集尾气,进行验纯。(8)若缺少装置D,则所测氧元素的质量分数将不变。
所以答案是:(1)3CO+Fe2O3![]() 2Fe+3CO2;将矿石中的二氧化硅等杂质转变为炉渣而除去的;(2)3C+2Fe2O3
2Fe+3CO2;将矿石中的二氧化硅等杂质转变为炉渣而除去的;(2)3C+2Fe2O3![]() 4Fe+3CO2↑;(3)通入CO;防止液体倒吸进入硬质粗玻璃管,造成炸裂且防止高温下铁又被进入的空气氧化;(4)红色变为黑色;红色物质;(5)澄清石灰水;Ca(OH)2+CO2=CaCO3↓+H2O;黑色粉末变成红色;(6)先点C处,后点A处;(7)排尽空气,防止爆炸;收集尾气,进行验纯;(8)不变;(9)0.6%;1.6%。
4Fe+3CO2↑;(3)通入CO;防止液体倒吸进入硬质粗玻璃管,造成炸裂且防止高温下铁又被进入的空气氧化;(4)红色变为黑色;红色物质;(5)澄清石灰水;Ca(OH)2+CO2=CaCO3↓+H2O;黑色粉末变成红色;(6)先点C处,后点A处;(7)排尽空气,防止爆炸;收集尾气,进行验纯;(8)不变;(9)0.6%;1.6%。
【考点精析】解答此题的关键在于理解铁的冶炼的相关知识,掌握铁冶炼的原料:铁矿石、焦炭、石灰石、空气;常见的铁矿石有磁铁矿(主要成分是Fe3O4 )、赤铁矿(主要成分是Fe2O3 ),以及对碳的化学性质的理解,了解各种单质碳的化学性质却完全相同;1、常温下的稳定性强2、可燃性:完全燃烧(氧气充足),生成CO2;不完全燃烧 (氧气不充足),生成CO;3、还原性:应用:冶金工业;现象:黑色粉末逐渐变成光亮红色,石灰水变浑浊.

 阅读快车系列答案
阅读快车系列答案