题目内容
【题目】为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的速率影响效果,某研究小组进行了如下探究: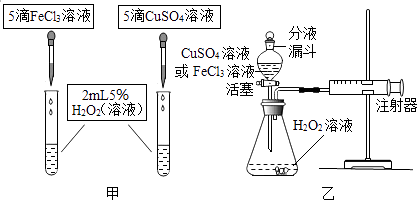
【定性研究】
(1)如图甲,可通过观察来定性比较两者的速率影响效果.
(2)【定量研究】
如图乙,实验前检查该装置气密性的方法是 . 要定量比较两者的速率影响效果,可测量生成等体积气体所需的 .
(3)【深入研究】
在FeCl3溶液中,究竟是哪种粒子影响过氧化氢的分解速率?
猜想1:水分子(H2O)影响过氧化氢的分解速率;
猜想2:影响过氧化氢的分解速率;
猜想3:影响过氧化氢的分解速率;…
请设计实验,验证猜想
实验操作 | 实验现象 | 实验结论 |
分别取同温度同体积同浓度的H2O2溶液于2支试管中,再分别加入等质量的FeCl3和NaCl.观察现象. | 加入FeCl3的试管中产生的气体快,加入NaCl的试管中产生的气体慢. | 证明是Fe3+影响过氧化氢的分解速率 |
(4)【反思与讨论】上述实验确实可以证明Fe3+可以改变过氧化氢的分解速率,但不能证明FeCl3是过氧化氢分解的催化剂.若要证明FeCl3是过氧化氢分解的催化剂,还需要通过实验证明FeCl3在反应前后 .
请写出FeCl3催化H2O2分解的化学方程式 .
【答案】
(1)产生气泡的速率
(2)先关闭分液漏斗,将注射器活塞向外拉,再松开手活塞又回到原来的位置,则装置气密性良好,时间
(3)氯离子(Cl﹣),铁离子(Fe3+)
(4)质量和化学性质不变,2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
【解析】解:(1)比较两种物质对过氧化氢分解速率的影响,可以观察二者产生气泡的速率;故填:产生气泡的速率;(2)检查该装置的气密性,可先关闭分液漏斗,将注射器活塞向外拉,再松开手活塞又回到原来的位置,则装置气密性良好;催化剂的催化效果越好,反应产生气体的速率越快,可通过测量产生等体积的氧气所需要的时间来分析,所需时间越短,催化效果越好;故填:先关闭分液漏斗,将注射器活塞向外拉,再松开手活塞又回到原来的位置,则装置气密性良好;时间;(3)氯化铁溶液中存在铁离子、氯离子和水分子,故猜想可能是铁离子或氯离子或水分子所起的催化作用;所以答案是:氯离子(Cl﹣);铁离子(Fe3+);(4)催化剂是在化学反应里能改变其他物质的化学反应速率(既能提高也能降低),而本身的质量和化学性质在化学反应前后都没有发生改变的物质;过氧化氢在氯化铁的催化作用下生成水和氧气,方程式为2H2O2 ![]() 2H2O+O2↑;故填:质量和化学性质不变;2H2O2
2H2O+O2↑;故填:质量和化学性质不变;2H2O2 ![]() 2H2O+O2↑。
2H2O+O2↑。
所以答案是:产生气泡的速率;先关闭分液漏斗,将注射器活塞向外拉,再松开手活塞又回到原来的位置,则装置气密性良好;时间;氯离子(Cl﹣);铁离子(Fe3+);质量和化学性质不变;2H2O2![]() 2H2O+O2↑。
2H2O+O2↑。
【考点精析】通过灵活运用检查装置的气密性和催化剂的特点与催化作用,掌握装置气密性检查:先将导管的一端浸入水中,用手紧贴容器外壁,稍停片刻,若导管口有气泡冒出,松开手掌,导管口部有水柱上升,稍停片刻,水柱并不回落,就说明装置不漏气;催化剂(触媒):在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质.(一变两不变)催化剂在化学反应中所起的作用叫催化作用即可以解答此题.

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
