题目内容
【题目】工业上以废旧锌锰电池中的黑锰粉[MnO2、MnO(OH)、NH4Cl、少量ZnCl2、炭黑及氧化铁等]为原料制备MnCl2,实现锰的再利用。其工艺流程如下:
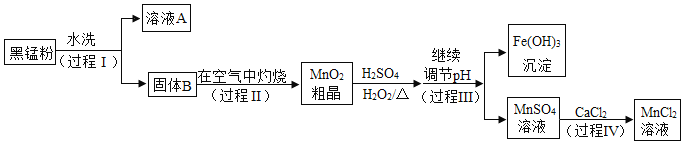
(1)过程Ⅰ、Ⅲ、Ⅳ中都需要的操作为______________。
(2)溶液A中的溶质除了NH4Cl,还含有____________(填化学式) 。
(3)过程Ⅱ的目的是除炭、氧化MnO(OH),其产物为三种常见氧化物,除CO2外,另外两种物质的化学式为______________。
(4)查阅资料:在pH>a的溶液中,Fe3+会转化成氢氧化铁沉淀,在pH>b的溶液中,Mn2+会转化成氢氧化锰沉淀。结合过程Ⅲ分析,可推测a_______b (填“>”、“<”或“=”)。
(5)结合复分解反应的条件和表中信息:过程IV的化学方程式为____________________。
MnSO4 | CaCl2 | MnCl2 | CaSO4 | |
溶解性 | 易溶 | 易溶 | 易溶 | 微溶 |
【答案】过滤 ZnCl2 MnO2、H2O < MnSO4+CaCl2=CaSO4↓+MnCl2
【解析】
(1)过程Ⅰ、Ⅲ、Ⅳ后都实现了固液分离,因此过程Ⅰ、Ⅲ、Ⅳ中都需要的操作为:过滤。
(2) 因为黑锰粉中MnO2、MnO(OH)、炭黑及氧化铁等都难溶于水,而NH4Cl、ZnCl2易溶于水,因此溶液A中的溶质除了NH4Cl,还含有ZnCl2。
(3)过程Ⅱ的目的是除炭、氧化MnO(OH),在空气中灼烧后炭转化为CO2,MnO(OH)转化为MnO2、H2O,因此得到的三种常见氧化物,除CO2外,另外两种物质的化学式为:MnO2、H2O。
(4)根据资料:在pH>a的溶液中,Fe3+会转化成氢氧化铁沉淀,在pH>b的溶液中,Mn2+会转化成氢氧化锰沉淀。结合过程Ⅲ分析,在Fe3+会转化成氢氧化铁沉淀时Mn2+没有转化成氢氧化锰沉淀,可见Mn2+转化成氢氧化锰沉淀时溶液的pH比Fe3+会转化成氢氧化铁沉淀时溶液的pH更大,因此可推测a<b。
(5)复分解反应发生的条件是反应物互相交换成分后,生成物中有沉淀、气体或水生成。结合复分解反应的条件和表中信息:过程IV中发生的反应,反应物是MnSO4和CaCl2,生成物是MnCl2和CaSO4,化学方程式为:MnSO4+CaCl2=CaSO4↓+MnCl2。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案【题目】分类、类比是初中化学常用的学习方法。请回答下列问题:
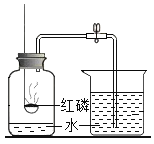
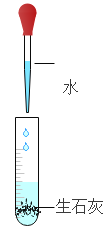
(1)初中化学有许多实验中都用到了水,但是用水作用是不同的,将下列实验中的 B 与_____(填字母)归为一类,理由是_____。
|
|
|
|
A | B | C | D |
(2)大爱无言,温暖随行,全国人民团结一致,抗击疫情。为了保证全校师生健康安全返回校园,黑龙江省侨青会联合斯迈尔生物有限公司为松雷中学捐赠了次氯酸消毒液 500 升。氯有很多化合价,+1 价氯元素和氧元素形成的原子团为-1 价的次氯酸根,则次氯酸的化学式_____;84 消毒液的主要成分为次氯酸钠,它是由 Cl2 和 NaOH 溶液反应制得,同时还会生成氯化钠和水,试写出此反应的化学方程式:_____。

【题目】金属在生产和生活中应用广泛。请回答下列问题。
(1)生活中常用铁锅做饭,主要利用了铁的_____性。
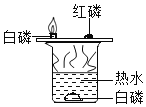
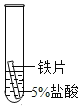
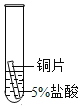
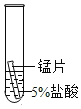
(2)某研究小组为探究铁、铜、锰(Mn)的金属活动性顺序,进行了如下三个实验(其中金属均已打 磨,且形状、大小相同,试管中所用 5%的盐酸体积相同)。
(实验记录与分析)
实验一 | 实验二 | 实验三 | |
实验操作 |
|
|
|
实验现象 | 立即产生气泡,速率较慢 | 无明显现象 | 立即产生气泡,速率较快 |
实验结论 | 铁、铜、锰的金属活动性顺序由强到弱为_____ | ||
写出实验一试管中发生反应的化学方程式_____。
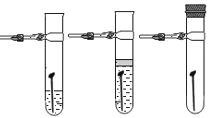
(3)小马同学根据上述结果,为了进一步证明三种金属的活动性,进行了如图所示的实验:
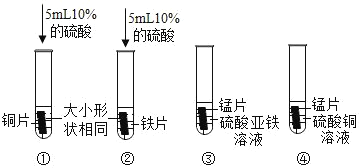
通过以上实验,也得出了与(2)相同的结论。小杨同学认为实验①~④中,不需要做的实验是_____(填 序号)。