题目内容
【题目】实验室利用不同的装置制取得到不同的气体。下图是实验室制取气体的各种装置。
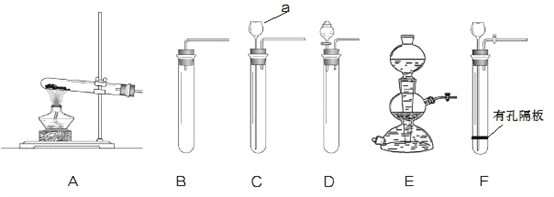
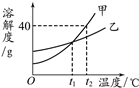
①图中仪器“a”的名称是______。制取气体的装置,放入药品前,均需对装置进 行______检查。
②上述装置按照不同角度可以分为两类,完成表格空白处:
分类依据 | 装置编号 | |
反应条件 | 加热 | A |
不加热 | BCDEF | |
(3) | 固体与固体 | A |
固体与液体 | BCDEF | |
若将“BCDEF”继续分为两类:“BCD”和“EF”两类,“EF”放在一起的理由是:________。
③如果实验室利用氯化铵固体与氢氧化钙固体在加热条件下得到氨气,选用的装置可以是______(选填图中装置编号);实验室利用大理石与稀盐酸反应制取 CO2,若要得到较 多的气体,装置宜选用_______(选填图中装置编号)。
④实验室利用大理石与稀盐酸反应制取 CO2,反应中共消耗了 3.65%的稀盐酸 100g,计算该 盐酸溶液中含 HCl 的物质的量是多少?可以得到 CO2 气体的质量是多少________?(请列式计算)
(7)计算 HCl 的物质的量:_______
(8)计算 CO2 气体的质量:________。
【答案】 分液漏斗 气密性 反应物状态 均可随开随用,随关随停 A E 3.65%×100/36.5=0.1 mol 2.2g
【解析】①图中仪器“a”的名称是长颈漏斗;制取气体的装置,放入药品前,均需对装置进 行气密性检查;②若将“BCDEF”继续分为两类:“BCD”和“EF”两类,“EF”放在一起的理由是:反应物状态均为固液不加热型,均可随开随用,随关随停;③如果实验室利用氯化铵固体与氢氧化钙固体在加热条件下得到氨气,属于固体加热型,选用的装置可以是:A;实验室利用大理石与稀盐酸反应制取 CO2,若要得到较多的气体,装置宜选用:E;④解:盐酸溶液中含 HCl 的物质的量为![]() ,设生成二氧化碳的质量为
,设生成二氧化碳的质量为![]() ,
,
CaCO3+2HCl![]() CaCl2+CO2↑+H2O
CaCl2+CO2↑+H2O
73 44
100g×3.65% ![]()
![]() ,
,![]() =4.4g。
=4.4g。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】某兴趣小组同学对NaOH、Na2CO3、NaHCO3、NaCl等常见的钠的化合物进行了研究。
【知识回顾】下列相关说法正确的是____。
A.氢氧化钠俗名叫烧碱,可用于改良酸性土壤 B.碳酸钠俗称纯碱,属于碱
C.碳酸氢钠俗称苏打,可用于治疗胃酸过多 D.氯化钠在自然界中主要存在于海水中
【提出问题】NaOH露置于空气中易变质,那么实验室中的氢氧化钠有没有变质呢?该小组同学对实验室中一瓶氢氧化钠固体样品的成分进行了探究。
【查阅资料】Ⅰ.NaOH在空气中不会转化成NaHCO3。
Ⅱ.BaCl2溶液呈中性,Ba(OH)2是可溶性碱。
Ⅲ.CO2在饱和的NaHCO3溶液中几乎不溶解。
【提出猜想】猜想①:样品中只有NaOH
猜想②:样品中只有Na2CO3
猜想③:样品中既有NaOH又有Na2CO3
NaOH变质反应的化学方程式为______________________。
【实验探究】兴趣小组同学设计如下实验进行探究。
实验操作 | 实验现象与结论 |
1.取少量样品,加足量水。 | 样品全部溶解,得无色溶液。 |
2.取少量实验1所得无色溶液于试管中,滴加足量稀盐酸。 | 有气泡产生,则猜想_____(填“①”、“②”或“③”)不成立。 |
3.取少量实验1所得无色溶液于试管中,滴加 ________溶液。 | 有白色沉淀产生,有关化学方程式为________。 |
4.静置一段时间后,取实验3中试管中上层清液,滴加 _______。 | 对应现象:____ ,则猜想③成立。 |
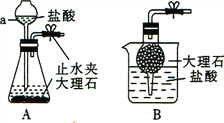
【定量研究】上述样品变质的程度如何呢?该兴趣小组同学设计如图装置测定样品中Na2CO3的质量分数。

步骤如下:
①按图连接好装置,并检查气密性;
②准确称取该样品1.0g,放入烧瓶内;
③打开分液漏斗活塞,滴加30.0%的稀硫酸至过量,关闭活塞;
④反应结束后,量筒内液体的读数为55.0mL。(已知:室温条件下,CO2的密度为1.6gL﹣1)
⑴ B装置集气瓶内原有的空气对实验结果____(填“有”或“没有”)影响。)
⑵ B中集气瓶盛装的饱和的碳酸氢钠溶液不能用水代替,其理由是___________________;
⑶ 充分反应后,装置A中残留的二氧化碳对实验结果是否有明显影响?____(填“有”或“没有”)
⑷ 计算该样品中Na2CO3的质量分数______(写出计算过程,结果保留到0.1%)。